
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Например, фтор окисляет хлор, бром и йод: Cl2 + F2 → 2ClF
Например, фтор окисляет хлор, бром и йод: Cl2 + F2 → 2ClF
II. Взаимодействие с металлами:
При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
железореагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3 I2 + Fe → FeI2
 Железо горит в атмосфере хлора- ЭКЗОТЕРМИЧЕСКАЯ реакция.
Железо горит в атмосфере хлора- ЭКЗОТЕРМИЧЕСКАЯ реакция.
Аналогичная ситуация с медью: фтор, хлор и бром окисляют медь до галогенидов меди (II), а йод до йодида меди (I):
Cl2 + Cu → 2CuCl2 I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
III. Взаимодействие с водой:вода горит в атмосферефтора синим пламенем:
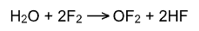
Олимпиадный вопрос. «Чем объясняется отбеливающее действие хлорной воды?»
При взаимодействии хлора с водой образуются две кислоты: соляная и хлорноватистая:
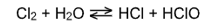
(реакция диспропорционирования).
Но хлорноватистая кислота очень неустойчива и разлагается на соляную кислоту и атомарный кислород: НСlО→НCl+ О, который и обладает очень сильными окислительными свойствами.
IV. Взаимодействие со щелочами:
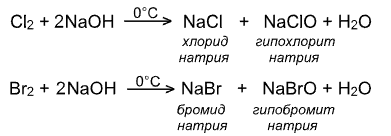
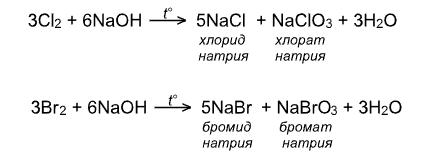
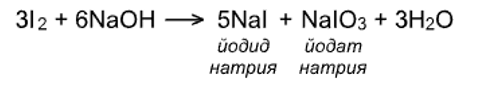
!!! Иод реагирует со щелочами исключительно по второму варианту, т.е. с образованием йодата, так как гипойодат не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
БЕЛИЛЬНАЯ (хлорная) известь:
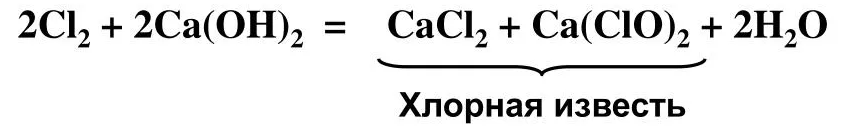
 - это смешанная соль!
- это смешанная соль!
Применение:
в качестве универсального средства от разных микроорганизмов
для очистки сточных вод, удаления известковых отложений в трубах;
востребована в химпроме в качестве сырья для получения хлорпроизводных, например хлороформа, хлорпикрина. На ее основе изготавливают пестициды, отбеливатели, средства для мытья и стирки.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|