
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O
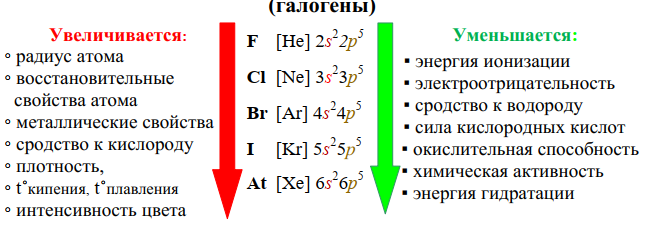

Нахождение галогенов в природе:
 Галогены- химически активные вещества, поэтому в природе они находятся только в виде соединений. Бром и иод собственных минералов не имеют. Их соединения содержатся в морской воде и накапливаются водорослями.
Галогены- химически активные вещества, поэтому в природе они находятся только в виде соединений. Бром и иод собственных минералов не имеют. Их соединения содержатся в морской воде и накапливаются водорослями.

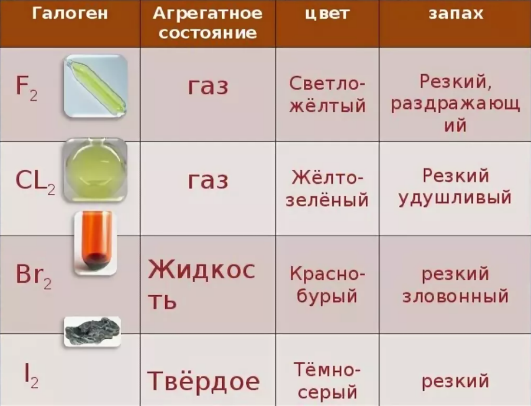 Физические свойства галогенов:
Физические свойства галогенов:
Способы получения:
ХЛОР:
Впервые получен Шееле в 1774 году.
В лабораторииполучают при взаимодействии концентрированной соляной кислоты с окислителями:
КMnО4, К2MnО4, MnО2
РbО2
К2Cr2О7, К2CrО4, CrО3
КClО3
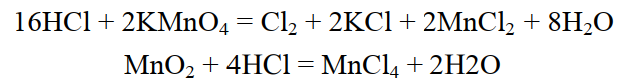
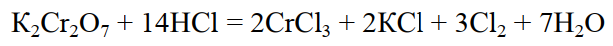
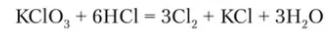
В промышленности хлор получают электролизом растворов или расплавов солей:
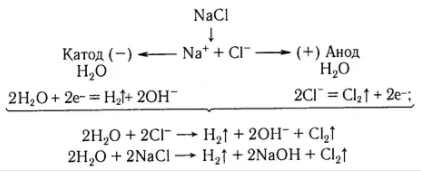
Получение брома:
В лабораторных условиях бром получают действием на различные окислители бромоводородной кислоты или ее солей в сернокислотной среде:
2 КМnO4 + 16 НВr = 2 КВr + 2 МnВr2 + 5 Вr2 + 8 Н2О
КСlO3 + 6 НВr = КСl + 3 Вr2 + 3 Н2O
2 КМnO4 + 10 КBr + 8 Н2SO4 = 6 К2SО4 + 2 МnSO4 + 5 Вr2 + 8 Н2О
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O
Получение иода:
Йод получают окислением ионов I– сильными окислителями.
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
2KI + MnO2 + 2H2SO4 → I2 + K2SO4 + MnSO4 + 2H2O
Химические свойства галогенов.
I. Взаимодействие с простыми веществами- неметаллами:
Галогены проявляют свойства окислителей. Они реагируют с металламиинеметаллами.
Галогены не горят на воздухе, т.е. не взаимодействуют с кислородом. Их оксиды получают только косвенным путем! Фтор окисляет кислород с образованием дифторида кислорода:
2F2 + O2 → 2OF2
При взаимодействии галогенов с серойобразуются галогениды серы:
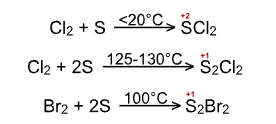
При взаимодействии фосфора с галогенами образуются галогениды фосфора:
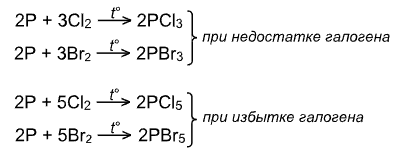
 Взаимодействие с водородом: образуются галогеноводороды (↑), при растворении которых в воде образуются одноименные кислоты.
Взаимодействие с водородом: образуются галогеноводороды (↑), при растворении которых в воде образуются одноименные кислоты.
Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|