
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Таким чином, відносною атомною масою речовини називають відношення маси атома даної речовини до 1/12 маси атома вуглецю :
Таким чином, відносною атомною масою речовини називають відношення маси атома даної речовини до 1/12 маси атома вуглецю :
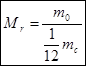 ,
,
Це відношення показує, у скільки разів маса атома даного елемента більша за 1/12 маси атома вуглецю .
Наприклад:
для кисню 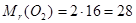
для вуглекислого газу 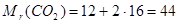
для метану 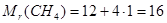
Відносна молекулярна маса – це безрозмірна величина.
Кількістю речовини  називають відношення числа молекул
називають відношення числа молекул  в даному тілі до числа
в даному тілі до числа 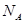 атомів в 0,012 кг вуглецю:
атомів в 0,012 кг вуглецю:
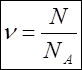 .
.
Вимірюють кількість речовини в молях.
Кількість речовини може обраховуватись за формулою: 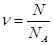 , або
, або 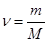 .
.
Моль – кількість речовини, яка містить стільки ж молекул, скільки атомів міститься в 0,012 кг (в 12 г ) вуглецю.
Наприклад, 1 моль водню  міститься в 2 г водню, 1 моль кисню
міститься в 2 г водню, 1 моль кисню  - в 32 г кисню.
- в 32 г кисню.
Масу 1 моль речовини називають молярною масою і позначають М. Одиницею молярної маси служить 1 кг/моль.
Молярна маса М – маса 1 моля речовини. Молярна маса дорівнює добутку маси молекули на сталу Авогадро.
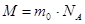 .
.
де m0 – маса молекули даного виду,  - число Авогадро.
- число Авогадро.
Відповідно, маса речовини:
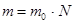 ,
,
де N – кількість молекул в речовині
Кількість молекул у ν молях речовини можна визначити за формулами:
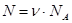 , або
, або  .
.
Доказом хаотичного руху молекул є спостережуваний під мікроскопом безладний безперервний рух нерозчинних у рідині малих крупинок твердої речовини, розмір яких має порядок 10-10м. У 1827 р. англійський ботанік Р.Броун, спостерігаючи квітковий пилок під мікроскопом, виявив, що він рухається.
Дифузія –це явище проникнення молекул одного виду у проміжки між молекулами іншого виду (Рис. 1).
Рисунок 1
Мікроскопічні властивості речовини, тобто її властивості при розмірах тіл, порівняних з розмірами молекул, мають статистичний характер. Це пояснюється хаотичністю руху молекул, скінченністю їх розмірів.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|