
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Декарбоксилирование α и β оксокислот.
Декарбоксилирование α и β оксокислот.
Α-оксокислоты в присутствии концентрированной серной кислоты отщепляют углекислый газ и превращаются в альдегид.

При незначительном нагревании β-оксокислоты отщепляют углекислый газ превращаясь в ацетон.
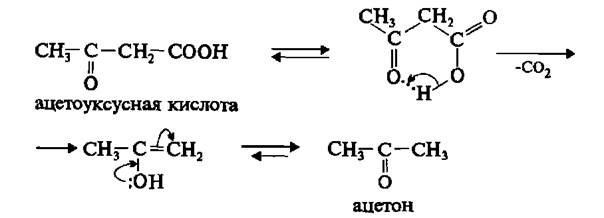
Γ и δ оксокислоты обладают всеми свойствами карбоновых кислот и карбонильных соединений.
Реакция внутримолекулярной циклизации.
Циклос гр круг.

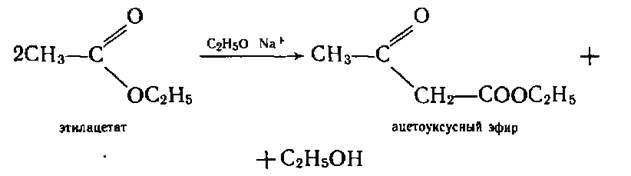
Ацетоуксусный эфир
В отличие от кислот сложные эфиры β-оксокислот довольно устойчивые соединения. Важное значение в орг синтезе имеет ацетоуксусный эфир.
Это бесцветная жидкость с приятным запахом. Температура кипения 181 С.
Синтез
Сложноэфирная конденсация этилацетата (Кляйзен)

Немецкий химик органик. Родился в 1851.
В 1887 году открыл реакцию получения β-кетоэфиров.
В 1893 году предложил использовать для перегонки под вакуумом особую колбу.

Свойства
Ацетоуксусный эфир таутомерное вещество.
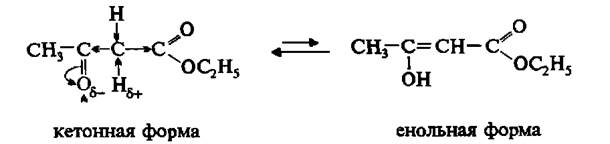
Енольная форма энергетически менее выгодна, чем кетонная. В спиртовом растворе ацетоуксусный эфир существует в равновесной смеси, состоящей на 92,5% из кетонной и на 7,5 – из енольной формы.
В химических превращениях ацетоуксусный эфир в зависимости от природы реагентов ведет себя как кетон или енол.
В кетонной форме ацетоуксусный эфир вступает в реакцию восстановления водородом, при взаимодействии с синильной кислотой образует циангидрин и дает другие реакции кетонов.
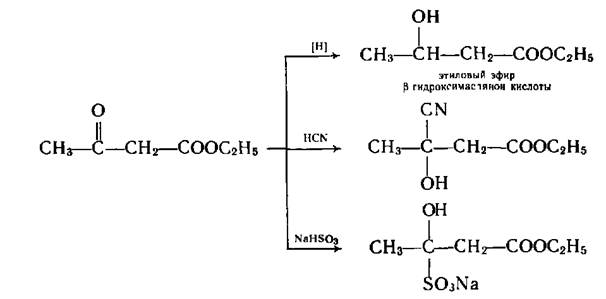
Наличие енольной формы обусловливает способность обесцвечивать бромную воду.
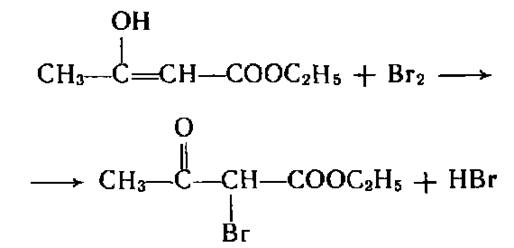
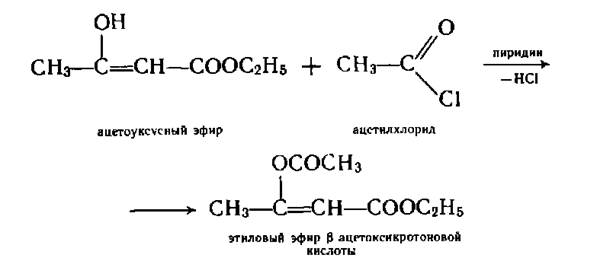
В енольной форме ацетоуксусный эфир дает фиолетовое окрашивание с хлоридом железа 3. С участием енольной формы эфир вступает в реакции ацилирования.
В енольной форме протекает реакция с натрием или гидроксидом натрия.
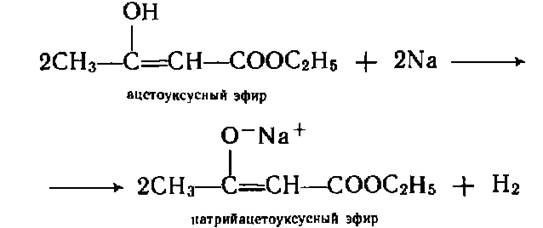
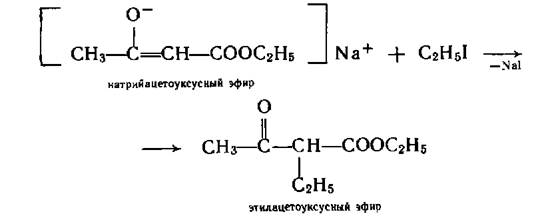
Натрийзамещенный ацетоуксусный эфир легко реагирует с галогеналканами. При этом алкилирование протекает не по атому кислорода, а по атому углерода.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|