
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Алгоритм решения задач. Примеры решения задач
Алгоритм решения задач
Уравнение состояния (2.1) связывает между собой пять физических величин, которые характеризуют состояние газа 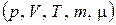 и позволяет по заданным четырем найти пятую величину.
и позволяет по заданным четырем найти пятую величину.
В общем случае алгоритм решения может быть такой. Из условий задачи определить, какие процессы происходят при переходе газа из начального состояния в конечное. Если газ последовательно совершает несколько различных процессов, целесообразно сделать схематический чертеж, на котором изобразить все процессы и обозначить параметры газа в начале и в конце каждого из них. Для начального и конечного состояния газа в каждом процессе следует записать уравнение Менделеева-Клапейрона для начального и конечного состояния газа в процессе или уравнение изопроцесса. Замкнуть полученную систему, решить ее и проанализировать полученный результат.
Если надо определить некоторый неизвестный параметр в смеси идеальных газов, не реагирующих между собой, тогда для решения целесообразно использовать уравнение состояния идеального газа, основное уравнение кинетической теории газа и закон Дальтона. Все описанные выше действия надо выполнить для каждой компоненты смеси отдельно, а результирующее давление смеси определить с помощью закона Дальтона.
Примеры решения задач
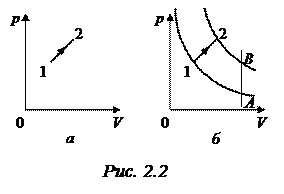 Задача 2.1.В координатах р, V (рис. 2.2 а) изображён график зависимости давления р от объема V при переходе идеального газа из состояния 1 в состояние 2. Как изменялась температура в этом процессе?
Задача 2.1.В координатах р, V (рис. 2.2 а) изображён график зависимости давления р от объема V при переходе идеального газа из состояния 1 в состояние 2. Как изменялась температура в этом процессе?
Решение. Проведем две изотермы так, что одна из них пройдет через точку 1, а вторая – через точку 2 (рис. 2.2 б). Обозначим через Т1 температуру, соответствующую первой изотерме, Т2 – второй изотерме. Чтобы выяснить, какая из этих температур выше, проведем произвольную изохору, пересекающую изотермы в точках А и В. При постоянном объеме, согласно закону Шарля, р/Т =
= const. Следовательно,
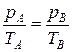 ,
,
где рА, рВ – давление газа в состояниях А и В соответственно; ТА, TВ – температура в этих состояниях. Отсюда находим
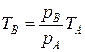 .
.
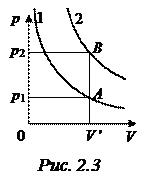 Но, как видно из рис. 2.2 б, рВ > рА. Следовательно, ТВ > ТА, т. е. для газа данной массы большему давлению соответствует бóльшая температура. Таким образом, мы приходим к выводу, что изотерма, проходящая через точку 2, соответствует более высокой температуре, чем изотерма, проходящая через точку 1, т. е. Т2 > Т1. Значит, температура газа при переходе из состояния 1 в состояние 2 увеличилась.
Но, как видно из рис. 2.2 б, рВ > рА. Следовательно, ТВ > ТА, т. е. для газа данной массы большему давлению соответствует бóльшая температура. Таким образом, мы приходим к выводу, что изотерма, проходящая через точку 2, соответствует более высокой температуре, чем изотерма, проходящая через точку 1, т. е. Т2 > Т1. Значит, температура газа при переходе из состояния 1 в состояние 2 увеличилась.
Задача 2.2. На рис. 2.3 изображены две изотермы для двух различных газов, имеющих одинаковые массу и температуру. Сравнить молярные массы этих газов.
Решение. По условию задачи газы имеют одинаковую массу m и одинаковую температуру Т. Рассмотрим на различных изотермах два состояния А и В, которым соответствует один и тот же объем 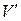 . Запишем уравнение Менделеева-Клапейрона для этих состояний:
. Запишем уравнение Менделеева-Клапейрона для этих состояний:
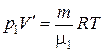 ,
, 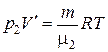 ,
,
где μ1, μ2 – молярные массы первого и второго газов соответственно.
Разделив почленно первое уравнение на второе, получим 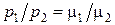 , откуда
, откуда
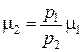 .
.
Учитывая, что 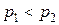 , приходим к выводу, что
, приходим к выводу, что 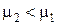 , т. е. изотерма 2 соответствует газу, имеющему меньшую молярную массу, чем газ, которому соответствует изотерма 1.
, т. е. изотерма 2 соответствует газу, имеющему меньшую молярную массу, чем газ, которому соответствует изотерма 1.
Как показано при решении этой задачи, изотермы, соответствующие одной и той же температуре, но различным газам, могут не совпадать вследствие различия масс и молярных масс газов, так как от этих величин зависит константа, входящая в математическое выражение закона Бойля-Мариотта (2.3). В самом деле, это выражение, как отмечалось выше, является частным случаем уравнения Менделеева-Клапейрона, поэтому
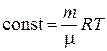 .
.
Отсюда видно, что константа имеет различные значения при различных m, μ и Т. Чем больше числовое значение этой константы, тем выше и правее будет располагаться соответствующая изотерма.
Задача 2.3. График зависимости давления р идеального газа от его температуры Т в некотором процессе изображен на рис. 2.4 а. Определить, сжимался или расширялся газ при переходе из состояния 1 в состояние 2.
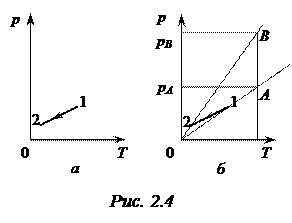 Решение. Используем прием, аналогичный примененному при решении предыдущей задачи. Проведем две изохоры, одна из которых проходит через точку 1, вторая – через точку 2 (рис. 2.4 б), т. е. первая изохора соответствует объему V1 в состоянии 1, вторая – объему V2 в состоянии 2. Проведем произвольную изотерму, пересекающую изохоры в точках А и В. Согласно закону Бойля-Мариотта, при постоянной температуре pV = const. Следовательно,
Решение. Используем прием, аналогичный примененному при решении предыдущей задачи. Проведем две изохоры, одна из которых проходит через точку 1, вторая – через точку 2 (рис. 2.4 б), т. е. первая изохора соответствует объему V1 в состоянии 1, вторая – объему V2 в состоянии 2. Проведем произвольную изотерму, пересекающую изохоры в точках А и В. Согласно закону Бойля-Мариотта, при постоянной температуре pV = const. Следовательно,
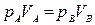 ,
,
где рА, VA – давление и объем газа в состоянии А; рB, VB – в состоянии В.
Отсюда
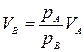 ,
,
а так как рA < рB, то VB < VА, т. е. для газа данной массы большему давлению соответствует меньший объем. Таким образом, мы приходим к выводу, что
V2 < V1, т. е. при переходе из состояния 1 в состояние 2 газ сжимался.
Задача 2.4. Начертить графики изотермического расширения идеального газа данной массы в координатах р, V; Т, V; ρ, р; ρ, Т, где р, V, Т и ρ – соответственно давление, объем, температура и плотность газа.
Решение. Как отмечалось выше, при изотермическом процессе (m = const, T = const) справедлив закон Бойля-Мариотта: pV = const. График этой зависимости (изотерма) в координатах р, V показан на рис. 2.5 а. В координатах Т, V эта изотерма дана на рис. 2.5 б.
Найдем теперь зависимость плотности идеального газа от давления и температуры. Как известно, плотность 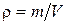 , для ее нахождения разделим обе части уравнения Менделеева-Клапейрона
, для ее нахождения разделим обе части уравнения Менделеева-Клапейрона 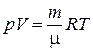 на объем, получим выражение для плотности идеального газа:
на объем, получим выражение для плотности идеального газа:
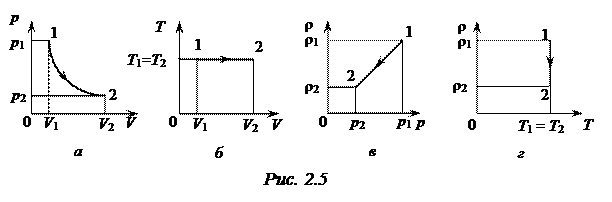
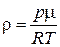 .
.
Отсюда видно, что при изотермическом расширении газа его плотность прямо пропорциональна давлению. Учитывая это, начертим графики в координатах ρ, р и ρ, Т (рис. 2.5 в, г соответственно).
Задача 2.5. Газ нагревается в открытом сосуде при нормальном давлении от температуры 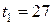
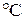 до
до 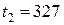
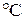 . Найти приращение концентрации молекул в сосуде.
. Найти приращение концентрации молекул в сосуде.
Решение. В связи с тем, что газ нагревается в открытом сосуде, давление газа остается постоянным, т. е.:
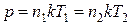 , (1)
, (1)
где 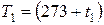 К,
К, 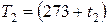 К – абсолютные температуры;
К – абсолютные температуры; 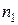 и
и 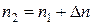 – концентрации молекул при температурах
– концентрации молекул при температурах 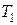 и
и 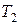 ;
; 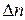 –приращение концентрации.
–приращение концентрации.
Из (1) следует
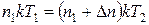
или
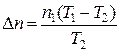 . (2)
. (2)
Согласно (1) 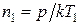 , тогда (2) принимает вид
, тогда (2) принимает вид
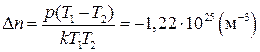 ,
,
т. е. концентрация газа уменьшается.
Задача 2.6.Найти молярную массу смеси газов, считая, что она состоит по массе из одной части кислорода и трех частей азота.
Решение. Если мы имеем смесь газов, то необходимо рассматривать так называемую молярную массу смеси 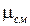 , которая должна удовлетворять уравнению состояния:
, которая должна удовлетворять уравнению состояния:
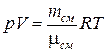 , (1)
, (1)
где 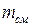 – масса смеси.
– масса смеси.
Но тот же самый закон мы можем записать для каждой компоненты смеси отдельно:
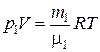 ,
, 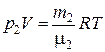 , (2)
, (2)
где 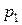 и
и 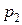 – парциальные давления каждой компоненты.
– парциальные давления каждой компоненты.
Для смеси газов выполняется закон Дальтона (2.7):
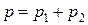 .
.
Подставив в последнее уравнение 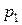 и
и 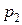 из уравнения (2), получим:
из уравнения (2), получим:
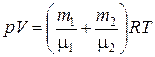 . (3)
. (3)
Сравнивая (1) и (3) и учитывая, что 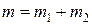 , для молярной массы смеси имеем:
, для молярной массы смеси имеем:
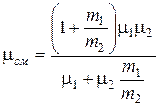 .
.
Подставив числовые значения ( 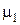 = 0,032 кг/моль,
= 0,032 кг/моль, 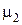 = 0,028 кг/моль и
= 0,028 кг/моль и 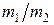 = 1/3), получим
= 1/3), получим 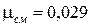 кг/моль. Полученное числовое значение приблизительно равно молярной массе воздуха, что не удивительно, поскольку воздух на 98,6 % состоит из азота и кислорода.
кг/моль. Полученное числовое значение приблизительно равно молярной массе воздуха, что не удивительно, поскольку воздух на 98,6 % состоит из азота и кислорода.
Задача 2.7.В баллоне объемом 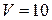 л находится гелий под давлением
л находится гелий под давлением 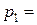 1 МПа, при температуре
1 МПа, при температуре 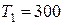 К. После того, как из баллона выпустили
К. После того, как из баллона выпустили 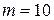 г гелия, температура в баллоне понизилась до
г гелия, температура в баллоне понизилась до 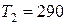 К. Определить давление
К. Определить давление 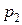 гелия, оставшегося в баллоне.
гелия, оставшегося в баллоне.
Решение. Применив уравнение Менделеева-Клапейрона к конечному состоянию газа, найдем давление:
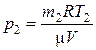 , (1)
, (1)
где 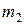 – масса гелия в баллоне в конечном состоянии.
– масса гелия в баллоне в конечном состоянии.
Массу 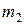 гелия выразим через массу
гелия выразим через массу 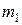 , которая соответствует начальному состоянию, и массу
, которая соответствует начальному состоянию, и массу 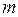 гелия, которую выпустили из баллона
гелия, которую выпустили из баллона
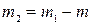 . (2)
. (2)
Массу 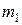 гелия найдем из уравнения Менделеева-Клапейрона, применив его к начальному состоянию:
гелия найдем из уравнения Менделеева-Клапейрона, применив его к начальному состоянию:
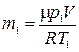 .
.
Подставим последнее выражение для массы 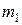 в уравнение (2), а потом
в уравнение (2), а потом 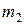 в (1), получим:
в (1), получим:
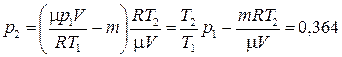 (МПа).
(МПа).
 Задача 2.8.Сколько ртути войдет в стеклянный баллончик объемом
Задача 2.8.Сколько ртути войдет в стеклянный баллончик объемом 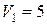 см3, нагретый до
см3, нагретый до 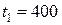
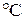 при его охлаждении до 16
при его охлаждении до 16 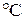 ? Плотность ртути при 16
? Плотность ртути при 16 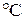 равняется
равняется 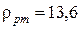 г/см3 (рис. 2.6).
г/см3 (рис. 2.6).
Решение. Ртуть входит в баллон при его охлаждении, поскольку при изобарном процессе с понижением температуры объем воздуха в баллоне должен уменьшиться. Обозначим через 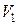 начальный объем воздуха в баллоне, после охлаждения объем воздуха уменьшится до
начальный объем воздуха в баллоне, после охлаждения объем воздуха уменьшится до 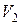 , поскольку часть объема баллона займет ртуть. Ртуть втягивается и поддерживает давление воздуха внутри баллона постоянным.
, поскольку часть объема баллона займет ртуть. Ртуть втягивается и поддерживает давление воздуха внутри баллона постоянным.
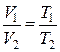 .
.
В баллон войдет ртуть массы

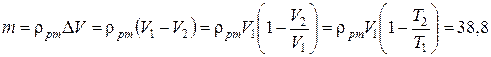 (г).
(г).
Задача 2.9.Воздух находится в цилиндре под свободно перемещающимся поршнем. Поршень находится на высоте 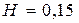 м. Цилиндр нагревается от
м. Цилиндр нагревается от 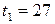
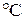 до
до 
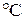 . Масса поршня
. Масса поршня 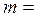 3 кг, площадь
3 кг, площадь 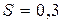 дм2. Определить работу, которую совершает воздух при расширении, передвигая поршень.
дм2. Определить работу, которую совершает воздух при расширении, передвигая поршень.
Решение. Поршень находится в равновесии, если 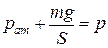 , где
, где 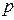 – давление воздуха снизу на поршень (рис. 2.7). Давление постоянное (поскольку поршень свободно передвигается), поэтому можно применить закон Гей-Люссака
– давление воздуха снизу на поршень (рис. 2.7). Давление постоянное (поскольку поршень свободно передвигается), поэтому можно применить закон Гей-Люссака
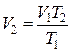 ,
,
где V1 – объем воздуха в цилиндре при температуре 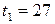
Работа
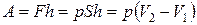
или
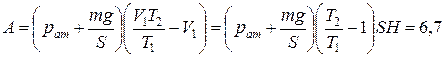 (Дж).
(Дж).
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|