
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ГАЗОВЫЕ ЗАКОНЫ. Краткие теоретические сведения
§2. ГАЗОВЫЕ ЗАКОНЫ
Краткие теоретические сведения
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона):
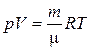 , (2.1)
, (2.1)
где 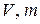 и
и 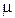 – объем, масса и молярная масса газа,
– объем, масса и молярная масса газа, 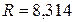 Дж/(моль×К) – универсальная газовая постоянная.
Дж/(моль×К) – универсальная газовая постоянная.
Универсальная газовая постоянная 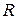 , постоянная Больцмана
, постоянная Больцмана 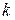 и число Авогадро
и число Авогадро 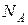 связаны между собой соотношением
связаны между собой соотношением
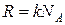 . (2.2)
. (2.2)
Уравнение состояния идеального газа можно применять к газам, которые находятся в условиях, близких к нормальным условиям, а также к разреженным газам. Для сильно сжатых газов, находящихся при больших давлениях (свыше 107 Па) или при низких температурах, уравнение (2.1) применять нельзя.
Изопроцессами называют процессы, протекающие при постоянной массе газа, отсутствии химических реакций ( 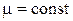 ) и неизменном значении одного из параметров: р, V или Т. Эти процессы подчиняются газовым законам, которые являются частными случаями уравнения Менделеева-Клапейрона (2.1).
) и неизменном значении одного из параметров: р, V или Т. Эти процессы подчиняются газовым законам, которые являются частными случаями уравнения Менделеева-Клапейрона (2.1).
При 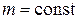 ,
, 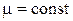 и
и 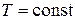 (изотермический процесс) на основании уравнения (2.1) получаем зависимость
(изотермический процесс) на основании уравнения (2.1) получаем зависимость
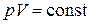 , (2.3)
, (2.3)
выражающую закон Бойля-Мариотта: для данной массы газа при отсутствии химических реакций и постоянной температуре произведение давления газа на его объем остается постоянным.
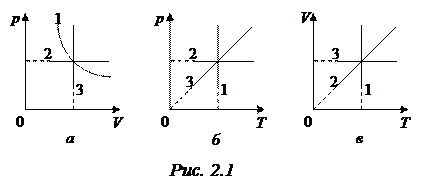 |
График зависимости (2.3) называется изотермой. В координатах
 (рис. 2.1 a) изотерма представляет собой гиперболу (обратно пропорциональная зависимость), в координатах
(рис. 2.1 a) изотерма представляет собой гиперболу (обратно пропорциональная зависимость), в координатах  (рис. 2.1 б) и
(рис. 2.1 б) и 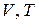 (рис. 2.1 в) изотерма 1 – прямая линия.
(рис. 2.1 в) изотерма 1 – прямая линия.
При 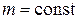 ,
, 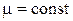 и
и 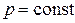 (изобарный процесс) из уравнения (2.1) следует:
(изобарный процесс) из уравнения (2.1) следует:
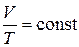 . (2.4)
. (2.4)
Эта зависимость называется законом Гей-Люссака: для газа данной массы при отсутствии химических реакций и при постоянном давлении отношение объема газа к его температуре остается постоянным.
График этой зависимости называют изобарой. В координатах 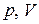 , а также
, а также 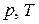 и
и 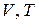 изобара 2 (рис. 2.1 а–в соответственно) – прямая.
изобара 2 (рис. 2.1 а–в соответственно) – прямая.
При 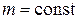 ,
, 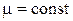 и
и 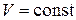 (изохорный процесс) из уравнения (2.1) имеем зависимость
(изохорный процесс) из уравнения (2.1) имеем зависимость
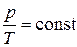 , (2.5)
, (2.5)
которая называется законом Шарля: для газа данной массы при отсутствии химических реакций при постоянном объеме отношение давления газа к его температуре остается постоянным.
График этой зависимости называется изохорой. В координатах 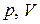 , а также
, а также 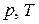 и
и 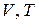 изохора 3 (рис. 2.1 а–в соответственно) – прямая.
изохора 3 (рис. 2.1 а–в соответственно) – прямая.
Объединенный газовый закон: при переходе газа из одного состояния в другое его макроскопические параметры изменяются так, что
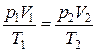 . (2.6)
. (2.6)
Закон Дальтона: давление смеси химически не взаимодействующих идеальных газов равняется сумме парциальных давлений газов, составляющих смесь:
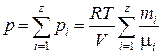 , (2.7)
, (2.7)
где 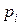 – парциальное давление
– парциальное давление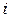 -ой компоненты,
-ой компоненты, 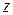 – количество компонент.
– количество компонент.
Парциальным давлением называют давление, которое создавал бы газ, входящий в состав газовой смеси, если бы все остальные газы отсутствовали (при температуре смеси).
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|