
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Номенклатура диенов
26.10.21. Химия. Группа 11. Занятие 22.
Тема занятия: «Алкадиены. Типы алкадиенов. Особенности свойств сопряженных алкадиенов».
Цель занятия: изучить, что представляют собой алкадиены и какие типы этого класса соединений существуют. Вы узнаете об особенностях свойств сопряженных алкадиенов, реакции галогенирования.
Ход занятия.
Номенклатура алкадиенов
Алкадиены (диены, диеновые углеводороды) – соединения, в молекулах которых присутствуют две двойные связи. Общая формула CnH2n-2.
Номенклатура диенов
СН2 = СН – СН = СН2
бутадиен-1,3 (дивинил)
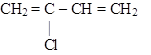
| 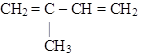
|
| 2-хлорбутадиен-1,3 (хлоропрен) | 2-метилбутадиен-1,3 (изопрен) |
Классификация диенов
Кумулированные диены – соединения, в молекулах которых две двойные связи расположены у одного и того же атома углерода: СН2=С=СН–СН2–СН3 (пентадиен-1,2)
Сопряженные диены – соединения, в молекулах которых две двойные связи разделены одной простой связью: СН2=СН–СН=СН–СН3 (пентадиен-1,3)
Изолированные диены – соединения, в молекулах которых две двойные связи разделены более чем одной простой связью. СН2=СН–СН2–СН=СН2 (пентадиен-1,4)
Строение сопряженных диенов
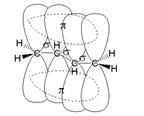
Рис. 1. Сопряжение орбиталей в бутадиене 1,3
Рассмотрим строение сопряженного алкадиена бутадиена-1,3. Молекула имеет плоское строение. Рис. 1. Все 4 атома С в sp2-гибридизации, 2 двойных связи. Однако длина этих двойных связей (0,135 нм) больше, чем у алкена (0,133 нм), а простая связь между атомами углерода (0,146 нм) короче, чем связь С-С в алканах (0,154 нм).
Две сопряженных двойных связи в химических реакциях часто ведут себя, как единое целое. Почему?
Происходит частичное перекрывание π-электронных облаков между 2-м и 3-м атомами углерода, и четыре р-орбитали образуют единое π-электронное облако. Такой тип перекрывания орбиталей называют сопряжением. Четыре электрона не локализованы попарно на двойных связях, а распределены вдоль всей цепи – делокализованы. Рис. 2.
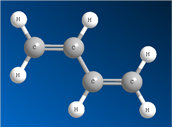
Рис. 2. Шаростержневая модель молекулы бутадиена-1,3
Свойства сопряженных диенов
Типичные реакции – электрофильное присоединение.
Реакция с избытком брома:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|