
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
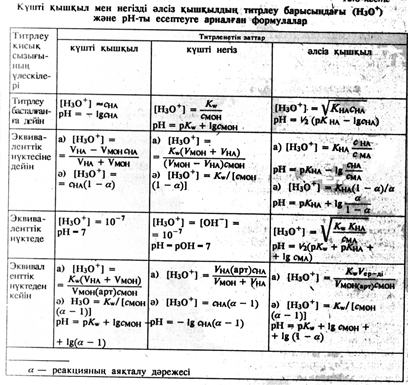
Күшті қышқылдар мен негіздерді титрлеудің қисық сызығы.
Күшті қышқылдар мен негіздерді титрлеудің қисық сызығы.
Титрлеу қисық сызығын жасау үшін рН мәнін анықтайды немесе қосылған стандартты ерітінділер көлеміне байланыста есептеп шығарады. Мысал үшін күшті қышқылды күшті сілтімен титрлеудің қисық сызығын есептеп шығаруды қарастырамыз, яғни 100 мл 0,1 моль/л HCl ерітіндісін 0,1моль/л NaOH ерітіндісімен (бөлме температурасында) титрлейді. Есептеудің қарапайым болуы үшін титрлеу кезінде ерітіндінің көлемі өзгермейді және иондардың концентрациясы мен активтігі арасындағы айырмашылық мардымсыз болады. Күшті қышқыл мен негіз сулы ерітіндіде іс жүзінде толық диссоциацияланады, сондықтан Н иондарының концентрациясы HCl дың концентрациясына тең болады, демек бастапқы сәтте:
[H+] = [HCl]=0,1моль/л, ал pH=1,00 HCl ерітіндісінің pH мәні эквиваленттік нүктеге дейін титрленбеген қышқылдың концентрациясымен анықталады. 50мл 0,1моль/л NaOH ерітіндісін қосқан кезде қышқылың 50проценті реакцияға түседі де сонша мөлшері титрленбей ерітіндіде қалады. Бұл ерітіндіде Н иондарының концентрациясы [H]=0,1∙0,5 =0,05 моль/л, яғни рН=2,70=1,3 болады, 90 мл сілті қосқанда ерітіндіде қышқылдың 10 проценті титрленбей қалады, ал [H]=0,1∙0,1=0,01моль/л, яғни pH=2,00 болады. 99,0мл сілті енгізгенде ерітіндіде [H]=0,1∙0,01=1,0∙10-3 , pH=3,00 ал егер 99,9мл сілті қосылса, pH=4,00болады. Қышқылдың барлығы сілтімен толық әрекеттессе эквиваленттік нүктеде ерітіндінің рН шамасы судың автопротолизімен анықталып, 7,00 –ге тең болады.
Эквиваленттік нүктеден кейін ерітіндінің рН шамасы қосылған сілтінің артық мөлшерімен анықталады, Н иондарының концентрациясын судың иондық көбейтіндісін есептей отырып анықтау керек. Егер эквиваленттік нүктеден кейін NaOH 0,1 қосылса, онда 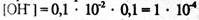 моль/л,
моль/л, 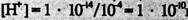 моль/л және рН=10,00 болады. 1,0 мл сілті қосқан кезде.
моль/л және рН=10,00 болады. 1,0 мл сілті қосқан кезде.
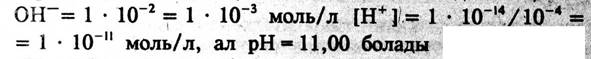
pH=7,0 кезіндегі абсцисса осіне параллель және ордината осін қиып өтетін түзу бейтарапттау сызығы деп, ал ордината осіне параллель, абцисса осін қиып өтетін түзу реагенттердің эквиваленттік мөлшері (немесе көлемі) кезінде эквиваленттік сызық деп аталады, бұл сызықтың сол жағында қышқылдың артық мөлшері, оң жағын ала артық сілті ерітіндісі болады. Титрлеу қисық сызығының эквиваленттік сызықты қиып өткен қилысындағы нүкте эквиваленттік нүкте, ал титрлеу қисық сызығының бейтараптау сызығындағы қиып өткен нүктесі бейтараптау нүктесі деп аталады. Күшті қышқылды күшті негізбен титрлеу кезінде эквиваленттік нүкте бейтараптау нүктесіне дәл келеді.
Эквиваленттік нүкте аймағында рН шамасының шұғыл өзгеруі титрлеу секіруі деп аталады.
Қисық сызықтың бұл бөлігі ең маңыздысы болып табылады, өйткені титрлеу секіруі бойынша титрлеу үшін индикаторды іріктеуді қажет етеді де кейбір басқа мәселелер де шешімін табады. рН тың шұғыл өзгеру аймағын реагенттердің концентрациясы мен титрлеу кезінде өтетін реакция тепе―теңдігімен анықталады. Секірудің мөлшерлік құны берілген анализ дәлдігіне байланысты белгіленеді. Көптеген титриметриялық әдістердің қателігі ±0,1% тен аспайды, сондықтан секіртпе шамасы ерітінді күйі 0,1% ке дейін титрленбегендей, 0,1% артық титрленгендегі күйінің рН өзгеруі болып саналады. Егер рұқсат етілген анализ қателігі 1% болса, онда титрлеу секіруі ерітіндінің 1% ке дейін титрленбей, 1%ке артық титрленуінің рН тық өзгеруімен есепке алынады. Бұдан жоғары қателік іс жүзінде рұқсат етілмейді. Жоғарыда қарастырылған нақтылы мысалда―0,1% аралықта титрлеу секіруі 6,0 рН бірлігін түзеді (рН 4тен рН 10ға дейін). Іс жүзінде титрлеу секіруі біраз төмен болады, өйткені титрлеу кезінде ерітінді сұйылып эквиваленттік нүктесі маңындағы ерітінді көлемі 2 есеге дерлік артады. Демек, сутек иондарының дәлме дәл концентрациясын қосылған титрант көлемін ескере отырып есептеген жөн. 99,9мл сілті қосылған кезде титрленген ерітіндінің көлемі 100+99,9 мл болады, мұнда [H]=0,1∙10-3∙100,0/199,9=5,0∙10 моль/л pH=5,7=4,3∙100,1мл қосқан кезде ерітінді көлемі 100+100,1=200,1мл, ал [OH]= 0,1∙10-3∙100,0/200,1=5,0∙10-5 моль/л, [H]=10-14/5∙10-5 =2∙10-10 , ал pH=9,7. Яғни титрлеудің шынайы секіруі рН 4,3-тен 9,7-ге дейін сұйылмаған есеп бойынша есептелген 6,0 емес, рН тың 5,4 бірлігі болады. Тек бұл айырмашылықтың онша үлкен шама еместігін ескеру керек. Күшті қышқылды күшті сілтімен титрлеген кезде эквиваленттік нүктесіндегі рН судың автопротолизімен анықталады және реагенттердің концентрациясына тәуелсіз болады. Бөлме температурасында теория бойынша судың pH=7,0 ге тең болады.
Титрлеудің секіру шамасы реагенттердің концентрациясына тәуелді болады. Мұны есептеуден көрнекі көре аламыз. Реагенттердің концентрациясы неғұрлым аз болса , титрлеу секіруі де, соғұрлым төмен болады. Төмендегі сүретте 100 мл 0,1 моль/л HCl ерітіндісінің сондай концентрациялы NaOH-пен титрлеудің қисық сызығы үзік сызықпен белгіленген. Мұндай жағдайда секіруі тек рН тың 4,0 бірлігі (5,0-тен 9,000-ға дейін) болады. Концентрация одан әрі азайған сайын реагенттердің секіруі азая түседі.
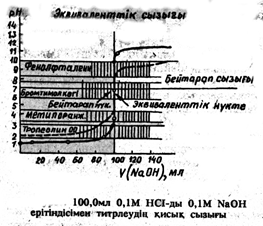
Температура артқан кезде судың иондық көбейтіндісі арта түседі де бұдан да титрлеу секіруі кемиді. Мысалы, 60 ˚С кезінде судың иондық көбейтіндісі 9,55∙10-14=10-13,02 ге тең болады, демек эквиваленттік нүктеде [H]=√10-13,02=10-6,51, ал рН=6,51. Қисық сызықтың тармақтары эквиваленттік нүктеге дейін барлық температурада іс жүзінде өзгеріссіз қалады, яғни ол титрленбеген қышқылдың концентрациясымен анықталады. Эквиваленттік нүктеден соң, мысалы, ерітінді 0,1% ке артық титрленгенде сутек иондарының концентрациясы [H]= 10-13,02/1∙10-4=10-9,02 , ал бөлме температурасындағыдай емес pH=9,02 болады. 60˚C та титрлеу секіруі бөлме тмпературасындағыдай 6,00емес рН тың 5,02 бірлігі (pH-4,00 тен pH-9,02ге дейін) болады.
Күшті негізді күшті қышқылмен титрлеу қисық сызығы осыған ұқсас есептеледі де күшті қышқылды күшті негізбен титрлеу қисық сызығының айнадағы бейнесіндей болып шығады. Эквиваленттік нүктеге дейін ерітінді рН ы титрленбеген сілтінің концентрациясымен, ал эквиваленттік нүктеден кейін қосылған қышқылдың концентрациясымен анықталады. Эквиваленттік нүктеде ерітіндінің рН мәні еріткіштікіндей болады. Секірудің қышқылды күшті негізбен титрлегендегідей қалпында қалады. Титрленетін ерітіндінің рН ын есептеуге арналған формулалар төмендегі кестеде келтірілген.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|