
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Получение. NaCl+ 2H2O→ 2NaOH+H2+Cl2. K2CO3+Ca(OH)2→CaCO3↓ + 2KOH. Li + 2H2O → 2LiOH + H2. Li2O + H2O → 2LiOH. Na2O2+ 2H2O → 2NaOH + H2O2. NaOH + CO2→ Na2CO3+ H2O. NaOH + HCl →NaCl + H2O
Получение
1.Электролиз растворов хлоридов:
2NaCl+ 2H2O→ 2NaOH+H2+Cl2
2.Обменные реакции между солью и основанием:
K2CO3+Ca(OH)2→CaCO3↓ + 2KOH
3.Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой:
2Li + 2H2O → 2LiOH + H2
Li2O + H2O → 2LiOH
Na2O2+ 2H2O → 2NaOH + H2O2
Химические свойства
R–OH – сильные основания (щелочи) реагируют с кислотными оксидами и кислотами:
2NaOH + CO2→ Na2CO3+ H2O
NaOH + HCl →NaCl + H2O
Соли щелочных металлов
— твердые кристаллические вещества ионного строения. Почти все соли натрия и калия растворимы в воде. Наиболее важные их соли — карбонаты, сульфаты, хлориды.
Nа2СO3 — карбонат натрия, образует кристаллогидрат Nа2СO3•10Н2O, известный под названием кристаллическая сода, которая применяется в производстве стекла, бумаги, мыла. Это средняя соль.
Вам в быту более известна кислая соль — гидрокарбонат натрия NаНСO3, она применяется в пищевой промышленности (пищевая сода) и в медицине (питьевая сода).
К2С03 — карбонат калия, техническое название — поташ, используется в производстве жидкого мыла и для приготовления тугоплавкого стекла, а также в качестве удобрения.
Nа2SO4 • 10Н2O — кристаллогидратат сульфата натрия, техническое название — глауберова соль, применяется для производства соды и стекла и в качестве слабительного средства.
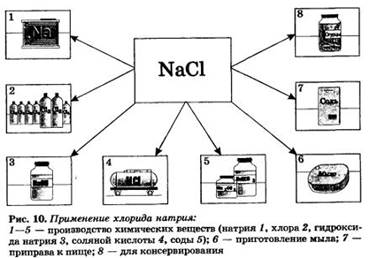
NаСl — хлорид натрия, или поваренная соль, эта соль вам хорошо известна из курса прошлого года. Хлорид натрия является важнейшим сырьем в химической промышленности, широко применяется и в быту (рис. 10).
Ионы натрия и калия играют большую биологическую роль:
Nа+ — главный внеклеточный ион, содержится в крови и лимфе, а К+ — основной внутриклеточный ион. Они выполняют разные функции в организме, но предпочитают «работать» вместе. Соотношение концентраций этих ионов регулирует давление крови в живом организме и обеспечивает перемещение растворов солей из корней в листья растений.
Самая значительная способность калия — поддерживать работу сердечной мышцы, поэтому нехватка калия в организме очень сказывается на здоровье человека. Калий необходим для всех растений, при его недостатке снижается интенсивность фотосинтеза растений.
Взрослый человек должен в сутки потреблять с пищей 3,5 г ионов калия. С помощью соединений калия можно устранить отеки, калий помогает при ревматизме, улучшает работу кишечника. В этом случае организму нужно больше калия — до 5 г в сутки. Больше всего калия содержат курага, соя, фасоль, зеленый горошек, чернослив, изюм и другие продукты.
Соли калия широко используются в сельском хозяйстве в качестве калийных удобрений.
Соли натрия, как и сам натрий, окрашивают пламя в желтый цвет, а соли калия и калий — в розово-фиолетовый.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|