
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Энтропия.
3. Энтропия.
Термодинамическая энтропия — термодинамическая функция, характеризующая меру необратимой диссипации энергии в ней.
[Диссипа́ция энергии — переход части энергии упорядоченных процессов в энергию неупорядоченных процессов, в конечном счёте — в теплоту.]
Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела, называемое приведенным количеством теплоты.
Приведенное количество теплоты, сообщаемое телу на бесконечно
малом участке процесса, равно δQ/T. Строгий теоретический анализ
показывает, что приведенное количество теплоты, сообщаемое телу в любом
обратимом круговом процессе, равно нулю.
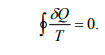
Из равенства нулю интеграла, взятого по замкнутому контуру,
следует, что подынтегральное выражение δQ/T есть полный дифференциал
некоторой функции, которая определяется только состоянием системы и не
зависит от пути, каким система пришла в это состояние. Таким образом,
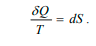
Функция состояния, дифференциалом которой является δQ/T, называется энтропией и обозначается S.
Энтропия замкнутой системы может либо возрастать (в случае
необратимых процессов), либо оставаться постоянной (в случае обратимых
процессов)
Если же система обменивается теплотой с внешней средой, то ее энтропия
может вести себя любым образом.
Если система совершает равновесный переход из состояния 1 в
состояние 2, изменение энтропии
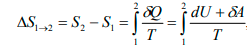
где подынтегральное выражение и пределы интегрирования
определяются через величины, характеризующие исследуемый процесс.
Формула определяет энтропию лишь с точностью до аддитивной
постоянной. Физический смысл имеет не сама энтропия, а разность
энтропий.
Энтропия обладает свойством аддитивности: энтропия системы
равна сумме энтропий тел, входящих в систему. Свойством аддитивности
обладают также внутренняя энергия, масса, объем (температура и давление
таким свойством не обладают).
Так как реальные процессы необратимы, то можно утверждать, что все
процессы в замкнутой системе ведут к увеличению ее энтропии – принцип
возрастания энтропии. При статистическом толковании энтропии это
означает, что процессы в замкнутой системе идут в направлении увеличения
числа микросостояний, иными словами, от менее вероятных состояний к
более вероятным, до тех пор, пока вероятность состояния не станет
максимальной.
Термодинамическая вероятность W состояния системы – это
число способов, которыми может быть реализовано данное состояние
макроскопической системы, или число микросостояний, осуществляющих
данное макросостояние (по определению, W≥1, т. е. термодинамическая
вероятность не есть вероятность в математическом смысле)
Согласно Больцману (1872), энтропия системы в термодинамическая
вероятность связаны между собой следующим образом:
S = k lnW,
где k – постоянная Больцмана.
Таким образом, энтропия определяется
логарифмом числа микросостояний, с помощью которых может быть
реализовано данное макросостояние. Следовательно, энтропия может
рассматриваться как мера вероятности состояния термодинамической
системы. Формула Больцмана позволяет дать энтропии следующее
статистическое толкование: энтропия является мерой неупорядоченности
системы. В самом деде, чем больше число микросостояний, реализующих
данное макросостояиие, тем больше энтропия. В состоянии равновесия –
наиболее вероятного состояния системы – число микросостояний
максимально, при этом максимальна и энтропия.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|