
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Почему различные атомы удерживают различное количество атомов водорода?
Почему различные атомы удерживают различное количество атомов водорода?
(каждый атом образует с другими атомами определенное количество связей).
Это называют валентностью.
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
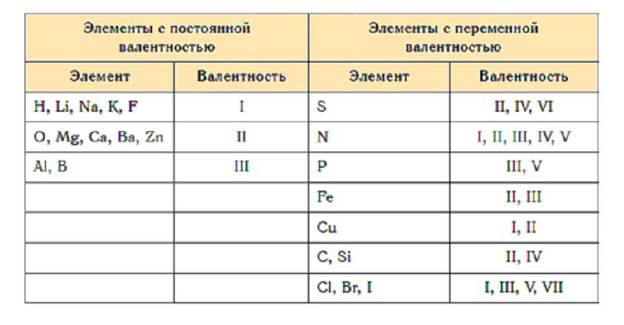
Все элементы можно разделить на три группы:
- с постоянной валентностью;
- с переменной валентностью;
- с нулевой валентностью.
Постоянная валентность химических элементов не меняется:
- у щелочных металлов, фтора (I);
- у щелочноземельных металлов, кислорода (II);
- у алюминия (III).
Переменная валентность характерна остальным элементам.
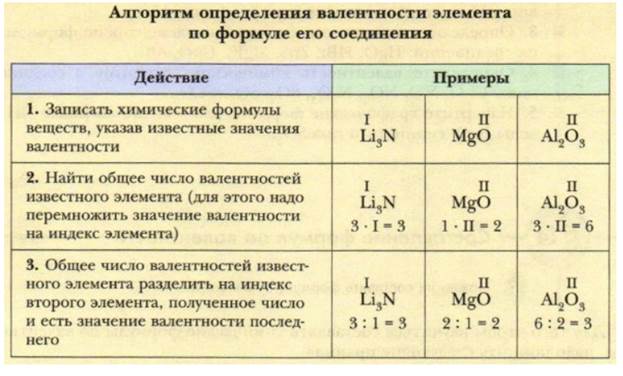
Как определить
Запоминать валентность каждого элемента необязательно. Достаточно посмотреть в таблицу Менделеева или использовать специальную таблицу валентности. В периодической таблице высшей валентности соответствует номер группы. Низшую валентность можно узнать, отняв от восьми номер группы.
Однако могут быть исключения. Например, кремний находится в IV группе, его высшая валентность – IV. Воспользовавшись формулой вычисления высшей валентности, можно прийти к выводу, что низшей валентности у кремния нет, она всегда равна IV. Однако это не так. Низшая валентность кремния – II. Другой пример: высшая валентность азота – V. Но элемент эту валентность проявляет редко, гораздо чаще – II и III.
Задания для выполнения:
1. Пройти тест по ссылке: https://obrazovaka.ru/test/tablica-valentnosti-himicheskih-elementov-8-klass.html
2. Определить валентность элементов в следующих соединениях: SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|