
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Аминокислоты
Аминокислоты
Как видно из названия, молекулы аминокислот содержат две функциональные группы:
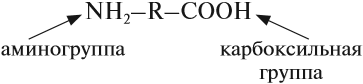
Простейшей аминокислотой является глицин:
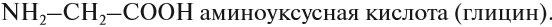
Функциональные группы аминокислот могут находиться на разном «расстоянии» друг от друга. Так, в ω-аминокапроновой кислот они находятся на противоположных концах молекулы:
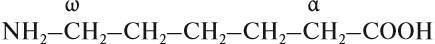
Эта кислота и её производные используются для получения синтетического волокна «капрон» (см. урок 28). Гораздо большее значение имеют α-аминокислоты, в молекулах которых функциональные группы разделены одним атомом углерода:
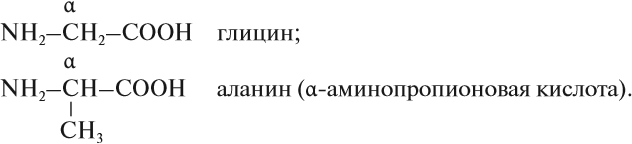
Эти α-аминокислоты входят в состав белков. Всего в состав белков входит постоянно 20 аминокислот. Все они имеют особые названия, и все они α-аминокислоты.
Аминокислоты — это кристаллические вещества, хорошо растворимые в воде.
Вопрос. Какую реакцию среды имеет такой раствор?
Аминокислоты диссоциируют в растворе:
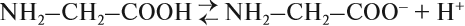
Ион водорода H+ тут же вступает в реакцию с анионом:

В результате в растворе нет избытка ни ионов водорода, ни ионов гидроксила, т. е. среда нейтральная (рН = 7).
Поскольку в состав аминокислоты входит оснОвная группа –NH2 и кислотная –СООН, аминокислоты могут реагировать и с кислотами:
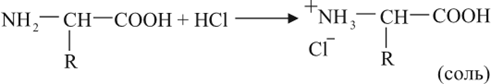
и с основаниями:
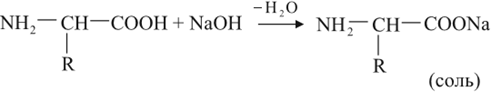
Белки
Белки — это природные полимеры (высокомолекулярные вещества), состоящие из остатков α-аминокислот.
Эти остатки соединены в длинную цепь за счёт пептидных связей:
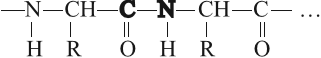
Атомы С–N образуют пептидную связь, которая соединяет остатки аминокислот в молекулах всех белков.
Эта полипептидная цепь определяет первичную структуру белка. Любое изменение первичной структуры белка влечёт за собой изменение всех свойств белка, так как формируется уже другой белок.
Длинная полипептидная цепь скручивается за счёт водородных связей в спираль:
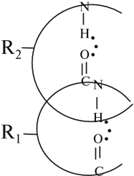
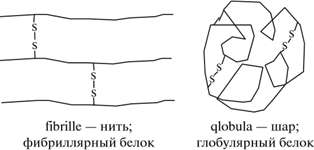
Формируется вторичная структура белка. Внутри этих спиралей за счёт радикалов происходят сложнейшие химические реакции. В результате молекулы белка изменяют свою форму, образуя нити (фибриллы) или «шарики» (глобулы):
Любой белок имеет столь сложную структуру, что всякое изменение её становится необратимым (белок не может «вспомнить» свою прежнюю структуру и восстановить её). Такие необратимые изменения происходят при нагревании свыше 40…60 °C, под действием кислот, щелочей, солей тяжёлых металлов, радиации и т. д. В результате этих и некоторых других воздействий происходит денатурация белка. При этом белок теряет свои природные (натуральные) свойства, так как изменилась вторичная и третичная структуры его:
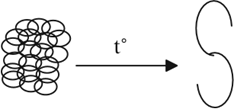
Денатурация белка является причиной гибели микроорганизмов при стерилизации медицинских инструментов, консервов. Она же является причиной тяжёлых отравлений солями меди, ртути, свинца и другими ядами. Денатурация происходит и при варке мяса, яиц.
Более глубокие изменения, затрагивающие первичную структуру белка (полипептидную цепь) происходят при гидролизе белка: белок + Н2О → смесь аминокислот.
Значение белков огромно: из них состоят все клетки нашего организма, они помогают нам дышать, обеспечивают организм энергией, защищают от вредных воздействий окружающей среды иммунитет, «запоминают» и воспроизводят наследственную информацию. Ни одна биохимическая реакция невозможна без ферментов, а любой фермент имеет белковую основу. Лучше всего значение белков подчеркнул Ф. Энгельс: «Жизнь — есть способ существования белковых тел».
Практическое задание:
Написать список продуктов, при употреблении которых человек получает белки.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|