
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Пример 1.. Пример 2.. Пример 3.
Пример 1.
Вычислить концентрацию ионов Н+ в растворе, в котором потенциал водородного электрода равен – 82 мВ.
Решение.
Из уравнения 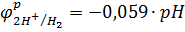 находим рН:
находим рН:
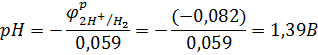
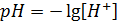
Следовательно, 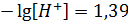 . Отсюда [H+] = 0,041 моль/л.
. Отсюда [H+] = 0,041 моль/л.
Ответ: [H+] = 0,041 моль/л.
Пример 2.
Рассчитайте равновесный потенциал электрода, на котором протекает реакция по уравнению
РbО2 + 4Н+ +  Рb2+ + 2Н2O
Рb2+ + 2Н2O
Стандартный потенциал равен 1,45 В. Концентрация иона Рb2+ равна 0,1 моль/л, рН = 10, Т = 298 К.
Решение. Потенциал окислительно-восстановительного электрода определяют по уравнению Нернста:
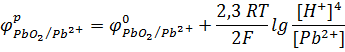
Подставляя числовые значения R, Т и F и преобразуя уравнение, получаем:
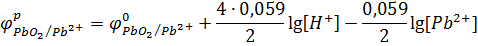
Так как
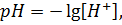 то уравнение примет вид
то уравнение примет вид
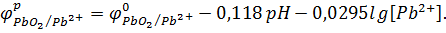
Подставим данные из условия задачи:
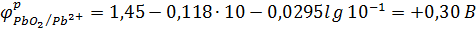
Ответ: 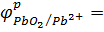 +0,30 B
+0,30 B
Пример 3.
Рассчитайте ЭДС элемента, в котором при 298 К установилось равновесие Zn0 + Ni2+ 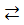 Zn2+ + Ni0 при концентрациях [Zn2+] = 0,01 моль/л, [Ni2+] = 10-3 моль/л. Напишите уравнения электродных реакций. Составьте схему гальванического элемента.
Zn2+ + Ni0 при концентрациях [Zn2+] = 0,01 моль/л, [Ni2+] = 10-3 моль/л. Напишите уравнения электродных реакций. Составьте схему гальванического элемента.
Решение. 1. Из таблицы стандартных электродных потенциалов металлов выписываем значения:
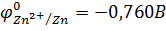
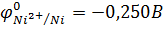
2. По уравнению Нернста рассчитываем равновесные потенциалы металлических электродов:
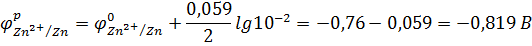
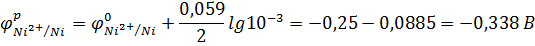
3. По значению равновесных электродных потенциалов определяем анод и катод: 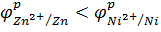 . Значит, Zn – анод; Ni – катод.
. Значит, Zn – анод; Ni – катод.
4. Рассчитываем ЭДС по формуле:
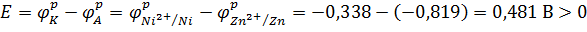
5. Записываем электродные процессы:
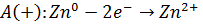
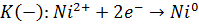
6. Записываем уравнение токообразующей реакции:
Zn0 + Ni2+  Zn2+ + Ni0
Zn2+ + Ni0
7. Уравнение в молекулярной форме:
Zn0 + NiCl2 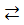 ZnCl2 + Ni0
ZnCl2 + Ni0
8. Составляем схему гальванического элемента:
(–) Zn | ZnCl2 || CuCl2 | Cu (+)
Варианты заданий
1. Рассчитайте равновесные потенциалы электродов гальванического элемента (1 балл).
2. Рассчитайте ЭДС гальванического элемента (1 балл).
3. Напишите электродные процессы (1 балл).
4. Напишите уравнение токообразующей реакции (1 балл).
5. Составьте схему гальванического элемента (1 балл).
| № варианта | Равновесие в гальваническом элементе при 298 K | Равновесные концентрации, моль/л |
Zn + 2Ag+  Zn2+ + 2Ag Zn2+ + 2Ag
| [Zn2+] = 10-2, [Ag+] = 10-4 | |
Cd + Cu2+  Cd2+ + Cu Cd2+ + Cu
| [Cd2+] = 10-3, [Cu2+] = 10-2 | |
Zn + Sn2+  Zn2+ + Sn Zn2+ + Sn
| [Zn2+] = 10-1, [Sn2+] = 10-2 | |
Fe + 2Ag+  Fe2+ + 2Ag Fe2+ + 2Ag
| [Fe2+] = 10-2, [Ag+] = 10-3 | |
Zn + Cu2+  Zn2+ +Cu Zn2+ +Cu
| [Zn2+] = 1, [Cu2+] = 10-2 | |
Pb + Ni2+  Pb2+ +Ni Pb2+ +Ni
| [Pb2+] = 10-4, [Ni2+] = 10-3 | |
Pb + Co2+  Pb2+ +Co Pb2+ +Co
| [Pb2+] = 10-3, [Co2+] = 10-2 | |
3Zn + 2Au3+  3Zn2+ + 2Au 3Zn2+ + 2Au
| [Zn2+] = 0,5, [Au3+] = 10-4 | |
3Cd + 2Al3+  2Cd2+ + 2Al 2Cd2+ + 2Al
| [Cd2+] = 10-2, [Al3+] = 1 | |
2Ag + Mg2+  2Ag+ +Mg 2Ag+ +Mg
| [Ag+] = 10-4, [Mg2+] = 10-1 | |
2Al + 6H+  2Al3+ + 3H2 2Al3+ + 3H2
| [Al3+] = 0,1, [H+] =10-2 | |
H2 + Sn2+  2H+ + Sn 2H+ + Sn
| [H+] =10-3, [Sn2+] = 10-2 | |
Pb + Cd2+  Pb2+ +Cd Pb2+ +Cd
| [Pb2+] = 1, [Co2+] = 10-2 | |
2Ag + Co2+  2Ag+ + Co 2Ag+ + Co
| [Ag+] = 10-4, [Co2+] = 0,5 | |
2Ag + Ni2+ 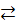 2Ag+ + Ni 2Ag+ + Ni
| [Ag+] = 10-3, [Ni2+] = 10-1 | |
Fe + 2H+  Fe2+ + H2 Fe2+ + H2
| [Fe2+] = 10-2, [H+] =10-4 | |
Al + Au3+  Al3+ + Au Al3+ + Au
| [Al3+] = 1, [Au3+] = 10-3 | |
Zn + Co2+ 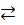 Zn2+ +Co Zn2+ +Co
| [Zn2+] = 1, [Co2+] = 1 | |
Mg + Sn2+  Mg2+ + Sn Mg2+ + Sn
| [Mg2+] = 10-2, [Sn2+] = 0,05 | |
Sn + Co2+  Sn2+ +Co Sn2+ +Co
| [Sn2+] = 10-2, [Co2+] = 10-4 | |
Cu + Cd2+  Cu2+ +Cd Cu2+ +Cd
| [Cu2+] = 10-2, [Cd2+] = 10-2 | |
Sn + Cd2+  Sn2+ +Cd Sn2+ +Cd
| [Sn2+] = 10-3, [Cd2+] = 1 | |
2Ag + 2H+  2Ag+ + H2 2Ag+ + H2
| [Ag+] = 10-2, [H+] =10-1 | |
Mg + Cu2+  Mg2+ +Cu Mg2+ +Cu
| [Mg2+] = 10-1, [Cu2+] = 10-2 | |
Fe + Pb2+  Fe2+ + Pb Fe2+ + Pb
| [Fe2+] = 10-2, [Pb2+] = 0,05 | |
2Au + 3Co2+  2Au3+ + 3Co 2Au3+ + 3Co
| [Au3+] = 10-3, [Co2+] = 1 | |
Sn + Pb2+  Sn2+ + Pb Sn2+ + Pb
| [Sn2+] = 1, [Pb2+] = 10-3 | |
Zn + Cd2+  Zn2+ +Cd Zn2+ +Cd
| [Zn2+] = 10-2, [Cd2+] = 0,05 | |
Cu + 2H+  Cu2+ + H2 Cu2+ + H2
| [Cu2+] = 10-2, [H+] =10-3 | |
2Ag + Fe2+  2 Ag+ + Fe 2 Ag+ + Fe
| [Ag+] = 10-2, [Ni2+] = 0,5 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|