
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема «Химические источники тока»
Практическое задание
Тема «Химические источники тока»
Краткие теоретические положения.
Простейшим источником тока является гальванический элемент. В нем энергия химической реакции преобразуется в электрическую работу. При соединении через внешнюю цепь двух полуэлементов на электроде с меньшим значением электродного потенциала происходит процесс окисления– электроны переходят во внешнюю цепь. Этот электрод является анодом.
На электроде с большим электродным потенциалом идет процесс восстановления, т.е. захват электронов из внешней цепи. Этот электрод называют катодом. Между полуэлементами обязательно должен находиться солевой мостик или пористая перегородка, позволяющая диффундировать анионам и снижающая разность потенциалов между двумя растворами. Классическим примером простейшего гальванического элемента является медно-цинковый элемент Даниэля.
Принцип действия любого химического источника тока одинаков, последние отличаются лишь рабочим веществом и, конечно, рабочими характеристиками: выходным напряжением, емкостью, возможностью перезарядки.
Электродвижущая сила гальванического элемента – максимальная разность потенциалов на концах равновесной электрохимической цепи:
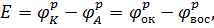
где 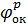 – равновесный электродный потенциал пары, выступающей в качестве окислителя;
– равновесный электродный потенциал пары, выступающей в качестве окислителя;
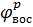 – равновесный электродный потенциал пары, выступающей как восстановитель.
– равновесный электродный потенциал пары, выступающей как восстановитель.
Равновесный электродный потенциал рассчитывается по формуле Нернста:

где 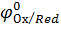 – стандартный электродный потенциал;
– стандартный электродный потенциал;
R – молярная газовая постоянная, 8,31 Дж/моль К;
T – абсолютная температура;
F – постоянная Фарадея, 96500 Кл/моль;
n – число электронов, участвующих в окислительно-восстановительном процессе;
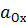 и
и  – активности окисленной и восстановленной форм вещества, участвующего в электродной реакции.
– активности окисленной и восстановленной форм вещества, участвующего в электродной реакции.
При подстановке значений постоянных величин R, F, стандартной температуры Т (250C = 298 К) и переходе к десятичным логарифмам:
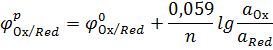
Для чистых твердых и жидких веществ 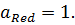
В разбавленных растворах активность равна молярной концентрации :
a = 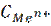 (моль/л).
(моль/л).
Тогда получаем следующее уравнение:
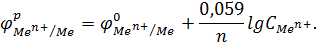
Для водородного электрода Pt, H2 | H+ зависимость электродного потенциала от рН среды:

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|