
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Название дисциплины: «ДУП 01.03. Основы естественных наук»
1. Название дисциплины: «ДУП 01.03. Основы естественных наук»
2. Номер группы: ТРМ 21-1
3. Форма и дата занятия: практическое занятие, 09.11.2021
4. ФИО преподавателя: Гумерова Сабарчан Шамсулеймановна soja1984renat@mail.ru,вк: 89526782142, https://vk.com/public194376261
5. Срок выполнения (сдачи) задания10.11. 2021г
ТемаМеталлы и неметаллы
Тема практического занятия: Взаимодействие металлов и неметаллов с кислотами
Задание.
1.Составить краткий конспект.
2. Заполнить таблицу, сделать вывод
Теоретический материал
Металлы –группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Свойства металлов, обусловлены наличием в их кристаллической решетке большого числа свободных электронов.
Обычно металлы применяют в виде сплавов. Металлический сплав представляет собой вещество, обладающее свойствами металлов и получаемое в результате взаимодействия двух или нескольких элементов.
Все металлы и сплавы можно разделить на черные (железо и сплавы на его основе) и цветные (все остальные металлы и сплавы).
К физическим свойствам металлов относят плотность, температуру плавления, цвет, блеск, непрозрачность, теплопроводность, электропроводность, тепловое расширение. По плотности металлы разделяют на легкие (до 3000 кг/м3) и тяжелые (от 6000 кг/м3 и выше); по температуре плавления – на легкоплавкие (до 973 К) и тугоплавкие (свыше 1173 К). Каждый металл или сплав обладает определенным, присущим ему цветом.
Из химических свойств металлов и их сплавов наиболее важными в производстве художественных изделий являются растворение (взаимодействие с кислотами и щелочами) и окисление (антикоррозийная стойкость, т.е. стойкость к воздействию окружающей среды – газов, воды и т.д.).
Общее химическое свойство, присущее металлам, – способность отдавать свои электроны в химических реакциях:
M – ne = Mn+
Мерой прочности связи электронов в атомах является энергия ионизации. Наименьшая энергия ионизации – у щелочных металлов, являющихся энергичными восстановителями. Восстановительными свойствами металлов обусловлена их способность реагировать с различными окислителями: неметаллами, кислотами, солями менее активных металлов.
По степени легкости отдачи электронов в растворах металлы располагают в ряд – ряд стандартных электродных потенциалов Е0 (приложение 4).
Ряд стандартных электродных потенциалов справедлив для окислительно-восстановительных процессов, происходящих только в водной среде.
Взаимодействие с кислотами
с учетом правил по положению металлов в ряду напряжения
K Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Au
- Металл в ряду должен стоять до водорода (не распространяется на щелочные и щелочноземельные металлы);
- Полученная соль должна быть растворимой;
- Азотная и концентрированная серная кислоты реагируют с металлами по – особому.
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Взаимодействие с солями
с учетом правил по положению металлов в ряду напряжения
K Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Au
- Металл в ряду должен стоять до металла соли (не распространяется на щелочные и щелочноземельные металлы);
- Все соли, участвующие в реакции должны быть растворимы;
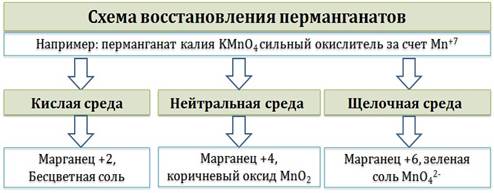
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|