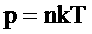Главная
Контакты
Случайная статья
|
Определение. Учет числа молекул (п.1). Причина - удары. молекул (п.2). Удары абсолютно упругие(модель).. Подстановка. Усреднение. Давление идеального газа прямо пропорционально средней кинетической энергии поступательного движения молекул, содержащихся в
Определение
|
Учет числа молекул (п.1)
|
Причина - удары
молекул (п.2)
|
Удары абсолютно упругие(модель).
| |
| 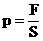
|
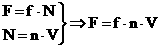
| 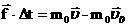
В проекциях:
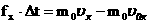
| 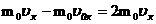
| |
| Предварительный итог:
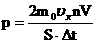
| |
| f- сила удара одной молекулы
| m0 - масса одной молекулы
| |
| Учет расстояний (п.3)
|
Подстановка
|
Усреднение
| Общий итог:
| |
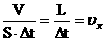
| 
| Все направления равноправны:
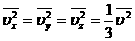
В среднем 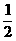 молекул имеет составляющую скорости, направленную к выбранной стенке: молекул имеет составляющую скорости, направленную к выбранной стенке: 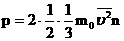
| 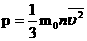
| |
| Это уравнение, выведенное впервые немецким физиком Р. Клаузиусом, называется основным уравнением молекулярно-кинетической теории идеального газа.Оно устанавливает связь между микроскопическими параметрами и макроскопическими (измеряемыми) величинами.
| 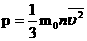
| |
| Учитывая, что 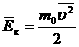 - средняя кинетическая энергия молекулы газа, получим: - средняя кинетическая энергия молекулы газа, получим: 
| 
| |
|
Давление идеального газа прямо пропорционально средней кинетической энергии поступательного движения молекул, содержащихся в единице объема газа.
|
| |
| Т.к. 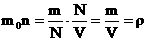 , то уравнение можно переписать в виде: , то уравнение можно переписать в виде: 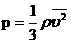
| 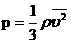
| |
| | | | | | | | | |
| Температура
|
| Важнейшим внутренним параметром газа является температура, чувствительность к которой заложена в живых системах, однако она субъективна («степеньнагретости тела»).
| 
|
| Основные свойства температуры
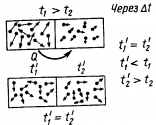
Тепловое (термодинамическое) равновесие – состояние тела или системы тел, при котором его термодинамические параметры (p, V, m и др.) остаются неизменными сколь угодно долго. Температура - характеристика внутреннего состояния макроскопической системы – состояния теплового равновесия.Температура – термодинамический параметр, одинаковый во всех частях термодинамической системы, находящейся в тепловом равновесии.Температуры тел, находящихся в тепловом контакте, выравниваются.
| 
|
| Измерение температуры.
1. Тело необходимо привести в тепловой контакт с термометром.
2. Термометр должен иметь массу значительно меньше массы тела.
3. Показание термометра следует отсчитывать после наступления теплового равновесия.
Термометры.
1. Жидкостный термометр (ртуть: температура от -38до 2600С; глицерин: от – 50 до 1000С) – тепловое расширение.
2. Термопара (температура от -269 до 23000 С).
3. Термисторы (зависимость сопротивления от температуры).
4. Манометрические (зависимость давления от температуры).
5. Газовые термометры – тепловое расширение.
6. Акустические, магнитные и др.
|
|
| Температурные шкалы:
1. Шкала Цельсия. 00С – таяние люда, 1000С – кипение воды (изначально – наоборот).
2. Шкала Реомюра. 00С - 00R, 1000С - 800R. → 10R=1,250С.
3. Шкала Фаренгейта. 00С=320F, 1000С=2120F → t0C=5/9(t0F-32).
Недостаток этих шкал – произвольность выборареперных точек (точек отсчета), их зависимость от внешних условий.
|
|
| Физический смысл температуры
|
Опыт: давление газа зависит от температуры -  и и 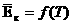 .
Из основного уравнения МКТ идеального газа: .
Из основного уравнения МКТ идеального газа: 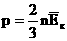 . Следовательно . Следовательно 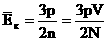 .
Если мы установим, как меняется это выражение при переходе от одного состояния теплового равновесия к другому, то можно будет ввести понятие температуры и изучить ее свойства. .
Если мы установим, как меняется это выражение при переходе от одного состояния теплового равновесия к другому, то можно будет ввести понятие температуры и изучить ее свойства.
| Физическая величина, одинаковая у любых тел при тепловом равновесии.
|
Опыт показывает, что для любых веществ 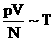 .
Заменяя знак пропорциональности на знак равенства, получим: .
Заменяя знак пропорциональности на знак равенства, получим: 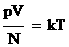 , где k – коэффициент пропорциональности, называемый постоянная Больцмана, а Т – абсолютная термодинамическая температура. , где k – коэффициент пропорциональности, называемый постоянная Больцмана, а Т – абсолютная термодинамическая температура.
| 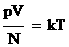
|
Абсолютная температура.
 - абсолютная температура неотрицательна!
Т.к. объем газа равен нулю быть не может, то температура равна нулю, если давление равно нулю, а значит, равна нулю скорость поступательного теплового движения (сохраняются т.н. нулевые колебания). - абсолютная температура неотрицательна!
Т.к. объем газа равен нулю быть не может, то температура равна нулю, если давление равно нулю, а значит, равна нулю скорость поступательного теплового движения (сохраняются т.н. нулевые колебания).
| 
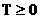
|
Единица температуры – Кельвин (К). Кельвин равен1/273,16 части термодинамической температуры тройной точки воды. Шкала строится так, что 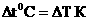 . .
| КЕЛЬВИН
1К
|
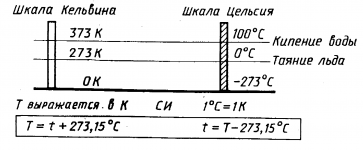
| Температура
абсолютного нуля не зависит от внешних условий и одинаковадля всех веществ.
|
| Связь температуры
и средней кинетической энергии поступательного движения молекул.
|
|
Сравнивая два выражения 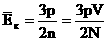 и и 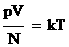 , получим: , получим: 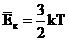 .
Т.о. средняя кинетическая энергия прямо пропорциональна абсолютной температуре.
Температура - мера средней кинетической энергии молекул. .
Т.о. средняя кинетическая энергия прямо пропорциональна абсолютной температуре.
Температура - мера средней кинетической энергии молекул.
| 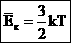
|
Постоянная Больцмана 
| 
|
| Температуру можно измерять в энергетических единицах – Джоулях.
При Т=0 средняя кинетическая энергия поступательного движения молекул равна нулю.
При комнатной температуре (300К) энергия примерно6.10-21Дж – очень маленькая (барабанные перепонки – шум в ушах; движение частиц мозга – передача сигналов).
|
|
Т.к. 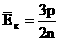 и и 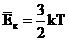 , то , то 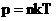 - связь давления итемпературы (еще одна форма основного уравнения МКТ идеального газа).
- связь давления итемпературы (еще одна форма основного уравнения МКТ идеального газа).
| 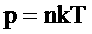
|

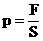
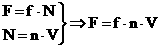
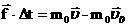
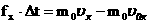
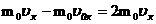
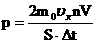
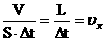

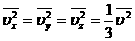
 молекул имеет составляющую скорости, направленную к выбранной стенке:
молекул имеет составляющую скорости, направленную к выбранной стенке: 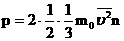
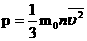
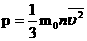
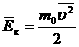 - средняя кинетическая энергия молекулы газа, получим:
- средняя кинетическая энергия молекулы газа, получим: 

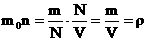 , то уравнение можно переписать в виде:
, то уравнение можно переписать в виде: 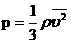
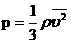


 и
и 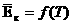 .
Из основного уравнения МКТ идеального газа:
.
Из основного уравнения МКТ идеального газа: 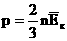 . Следовательно
. Следовательно 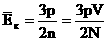 .
Если мы установим, как меняется это выражение при переходе от одного состояния теплового равновесия к другому, то можно будет ввести понятие температуры и изучить ее свойства.
.
Если мы установим, как меняется это выражение при переходе от одного состояния теплового равновесия к другому, то можно будет ввести понятие температуры и изучить ее свойства.
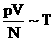 .
Заменяя знак пропорциональности на знак равенства, получим:
.
Заменяя знак пропорциональности на знак равенства, получим: 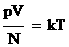 , где k – коэффициент пропорциональности, называемый постоянная Больцмана, а Т – абсолютная термодинамическая температура.
, где k – коэффициент пропорциональности, называемый постоянная Больцмана, а Т – абсолютная термодинамическая температура.
 - абсолютная температура неотрицательна!
Т.к. объем газа равен нулю быть не может, то температура равна нулю, если давление равно нулю, а значит, равна нулю скорость поступательного теплового движения (сохраняются т.н. нулевые колебания).
- абсолютная температура неотрицательна!
Т.к. объем газа равен нулю быть не может, то температура равна нулю, если давление равно нулю, а значит, равна нулю скорость поступательного теплового движения (сохраняются т.н. нулевые колебания).
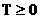
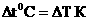 .
.

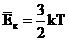 .
Т.о. средняя кинетическая энергия прямо пропорциональна абсолютной температуре.
Температура - мера средней кинетической энергии молекул.
.
Т.о. средняя кинетическая энергия прямо пропорциональна абсолютной температуре.
Температура - мера средней кинетической энергии молекул.
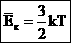


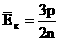 и
и 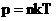 - связь давления итемпературы (еще одна форма основного уравнения МКТ идеального газа).
- связь давления итемпературы (еще одна форма основного уравнения МКТ идеального газа).