
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
w(х)= ; m(х)= w(х)´m(р-ра); m(x)= 0,95´100= 95 г. СаСО3.
w(х)= ; m(х)= w(х)´m(р-ра); m(x)= 0,95´100= 95 г. СаСО3.
г) Находим массу HCl, которая пошла на обработку мрамора.
m(HCl) = w(HCl)  m(p-pa); m(HCl)= 0,25
m(p-pa); m(HCl)= 0,25 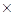 200= 50 г. HCl.
200= 50 г. HCl.
д) Проставляем найденные значения CaCO3 и HCl в уравнение реакции.
е) Находим по уравнению какое из реагирующих веществ взято в избытке.
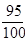 >
> 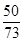 ; 0,95> 0,68.
; 0,95> 0,68.
ж) Составляем пропорцию по кислоте.
50 г. HCl – х г. СО2
73 г. HCl – 44 г. СО2
х = 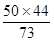 ; х = 30,14 г. СО2
; х = 30,14 г. СО2
з) Записываем ответ: 30,14 г. СО2
Методические рекомендации к выполнению:
1. Правильно найдите данные задачи и, введя их обозначения, составьте дано задачи.
2. Определите, что нужно найти и выберите правильные формулы для расчета.
3. Записываем уравнение химической реакции и ведем расчет по уравнению.
4. Номер варианта в таблице соответствует вашему номеру в классном журнале.
5. Работа, выполненная не по своему варианту не засчитывается.
Задача №1
Смешали аммиак массой 5,1 г. с хлороводородом массой 12 г. Какое вещество и в каком количестве образовалось?
Задача №2
Сколько килограммов раствора серной кислоты с массовой долей Н2SO4 80% необходимо для получения сульфата аммония из аммиака массой 51 кг? Какое количество (NH4)2SO4 образовалось.
Задача №3
Определить массу преципината ( гидрофосфат кальция), который образуется в результате взаимодействия гидроксида кальция массой 43г. с фосфорной кислотой массой 85г.?
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|