
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Катализ. Термическое окисление
3.6.3 Катализ
Общие сведения каталитической очистки газов. Каталитическая очистка газов основана на гетерогенном катализе и служит для превращения примесей в безвредные соединения. Процесс протекает на поверхности твердых тел — катализаторов. В настоящее время вопрос о том, какие реакции и в присутствии каких веществ могут возбуждаться, остается решенным неполностью и поэтому подбор катализаторов и проведение катализа в основном решается эмпирическим путем.
Для того чтобы произошла химическая реакция между атомами, молекулами и ионами, необходимо их непосредственное взаимодействие. При температуре 500 градусов в одном куб. см реакционной смеси происходит 1028 столкновений частиц в секунду. Но не каждое столкновение приводит к химической реакции. Химическая реакция происходи лишь в том случае, когда система обладает необходимым запасом внутренней энергии (активации), если частицы сближаются на расстояние, при котором происходит перекрытие их электронных облаков, а, следовательно, и перераспределение электронных плотностей. Только в этом случае может произойти разрушение старых и образование новых химических связей.
Энергия активация является основным фактором, определяющим скорость реакции. Чем больше энергия активации, тем меньше частиц обладают в системе такой энергией и тем медленнее протекает реакция. В то же время, величина энергии активации значительно меньше энергии, требуемой для разрыва старых связей, она часто компенсируется энергией, освобождаемой при образовании новых. Задача преодоления энергетических барьеров решается путем использования катализаторов, которые снижают энергию активации и тем самым увеличивают скорость химической реакции. Таким образом, роль катализаторов с энергетической точки зрения сводится к понижению энергетического барьера, который должна преодолеть система при переходе из начального состояния в конечное.
Катализ на твердых телах складывается из следующих стадий:
— внешняя диффузия реагирующих веществ к поверхности катализатора;
— внутренняя диффузия в порах зерна катализатора;
— химическая адсорбция одного или нескольких реагирующих компонентов на поверхности катализатора;
— перегруппировка атомов (химическая реакция);
— обратная диффузия продукта в порах зерна катализатора;
— диффузия продуктов от поверхности зерна.
Каждая из стадий каталитического процесса должна обладать энергией активации значительно меньшей, чем энергия активации в отсутствии катализатора, иначе каталитический процесс окажется энергетически невозможен. Общая скорость каталитического процесса определяется относительными скоростями отдельных стадий и может лимитироваться наиболее медленной из них. Различают три основные области протекания каталитических процессов: кинетическую, внешнедиффузионную и внутридиффузионную. В зависимости от стадии, лимитирующей общую скорость процесса, используются различные уравнения кинетики процесса. Говоря о лимитирующей стадии процесса, предполагают, что остальные стадии протекают настолько быстро, что в каждой из них практически достигается равновесие и свободная энергия Гиббса равна нулю.
В кинетической области суммарная скорость лимитируется скоростью химической реакции и не зависит от процессов переноса, а зависит лишь от природы реагирующих веществ. В кинетической области протекают реакции при использовании малоактивных катализаторов и при температурах близких к температуре зажигания катализаторов. Скорость таких процессов невозможно увеличить улучшением структурных свойств катализатора (увеличением микро- и макропор). Ее можно увеличить, лишь изменяя природу катализаторов, а также повышая температуру процесса. В то же время катализатор должен иметь развитую структуру микро- и макропор, обеспечивающую подвод реагирующих веществ в зону реакции.
Во внешнедиффузионной области суммарная скорость каталитического процесса лимитируется скоростью подвода реагирующих веществ в зону реакции. При этом предполагается, что химическая реакция протекает мгновенно. Каталитические процессы, протекающие во внешнедиффузионной области, можно ускорить увеличивая макропоры (наружной поверхности) катализатора и перемешивая реагенты. Увеличивать поверхность микропор нецелесообразно, т. к. они практически не участвуют в процессе катализа. Пределом увеличения турбулизации потоков служит переход системы из внешнедиффузионной во внутридиффузионную или кинетическую области.
Во внутридиффузионной области суммарная скорость каталитического процесса лимитируется скоростью подвода реагирующих веществ в зону реакции в микропорах зерна катализатора. Увеличить скорость таких процессов можно путем уменьшения размеров зерна катализатора или увеличением внутренней поверхности катализатора, создаваемой тонкими порами малой длины. Большинство процессов тормозится внутренней диффузией, поэтому синтезируемые катализаторы должны обладать микропористой структурой.
Большое влияние на процесс катализа оказывает температура. Она может изменять не только скорость процесса, но и лимитирующую стадию процесса. При относительно низких температура, где скорость реакции мала по сравнению со скоростью диффузии, концентрации реагирующих веществ и продуктов реакции по глубине зерна уменьшаются незначительно и близки к концентрации их в газовом потоке, т. е. С1 = С2 = С3 = Сн (рис. 3.18). Процесс катализа протекает в кинетической области.
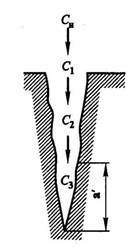
Рис. 3.18. Схема процесса переноса вещества по глубине поры катализатора
С ростом температуры скорость химической реакции увеличивается, увеличивается и скорость диффузии.
Однако константа скорости реакции увеличивается значительно быстрей и в этих условиях подвод реагирующих веществ путем диффузии не в состоянии обеспечить постоянную концентрацию реакционной смеси по всей глубине поры катализатора. При определенной температуре наступит момент, когда компонент вступит в химическую реакцию еще до того, как он проникнет на полную глубину катализатора, т. е. С3 = 0. Следовательно, какая-то часть внутренней поверхности поры катализатора (область а) из-за недостатка исходных веществ фактически не будет принимать участия в катализе. Таким образом, каталитический процесс переводится в область внутренней диффузии. Степень использования внутренней поверхности катализатора становится равной меньше единицы. Скорость катализа в этом случае будет лимитироваться процессом переноса вещества в микропорах катализатора. При дальнейшем увеличении температуры степень использования внутренней поверхности еще больше уменьшается, и подводимые в зону реакции вещества будут вступать в реакцию, не проникая глубоко в поры катализатора.
В определенный момент степень использования внутренней поверхности становится равной нулю, и суммарная скорость определяется только скоростью подвода реагирующих веществ из газового потока к наружной поверхности катализатора, т. е. катализ перейдет в область внешней диффузии.
Таким образом, для реакций, протекающих в кинетической области, катализатор должен обладать высокой активностью и иметь развитую внутреннюю поверхность макро- и микропор, которые обеспечивали бы подвод необходимого количества реагентов в зону реакции. Для реакций, протекающих в области внешней диффузии, мелкие поры катализатора почти не играют никакой роли, но зато возрастает значение крупных пор и внешней поверхности. В этом случае целесообразно использовать крупнопористые катализаторы с развитой внешней поверхностью. В реакциях, протекающих в области внутренней диффузии, главную роль играют мелкие поры. Для таких реакций необходимо использовать катализаторы с развитой внутренней поверхностью.
Важнейшей характеристикой катализаторов является температура зажигания — минимальная температура, при которой катализатор начинает проявлять свои свойства.
В принципе, катализаторы в ходе катализа не претерпевают никаких изменений (в некоторых процессах катализаторы работают более 20 лет). Однако постепенно активность катализаторов теряется. Причиной этого могут быть физические и химические факторы.
К физическим относятся истирание, перегрев, спекание и т. д.
Химические факторы являются значительно более сложной проблемой, возникающей в процессе каталитической очистки газов. К ним относится постепенное насыщение поверхности катализатора различными примесями, называемыми каталитическими ядами. В результате уменьшаются активные центры на поверхности катализатора и постепенно теряется активность катализатора. Одни и те же вещества могут являться каталитическими ядами для одних катализаторов и совершенно не причинять вреда другим. Если эти вещества можно удалить с поверхности катализатора, то его активность восстанавливается. В соответствии с этим различают обратимую и необратимую отравляемость катализаторов. При обратимой отравляемости их активность полностью восстанавливается после удаления каталитических ядов. При необратимой катализатор не восстанавливает их свойств даже после удаления ядов из зоны реакции. Основными каталитическими ядами являются соединения серы, свинца, фосфора и др.
3.6.4 Термическое окисление
Термическим называется окисление компонентов выбросов при высокой (800–1000оС) температуре. Оно применяется как в отношении газов (паров), так и горючих компонентов дисперсной фазы аэрозолей (смол, масел, летучих растворителей и др.). Основными факторами термического окисления являются: температура, интенсивность перемешивания (турбулентность газовых потоков) и время пребывания газов в реакционной зоне. Решающее значение в организации процесса имеет подготовка газов к реакции, т. е. нагрев смеси до необходимой температуры и обеспечение смешения горючих газов с окислителями. Если обезвреживаемый газ содержит в своем составе достаточное для окисления токсичных примесей количество кислорода, либо этот кислород добавляется к обезвреживаемому газу заблаговременно, то процесс смешивания газов упрощается.
Процесс термического окисления некоторых газов описывается уравнением:
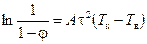 , (3.67)
, (3.67)
где j — степень обезвреживания газа; t — время протекания процесса; А — эмпирический коэффициент, отражающий аэродинамические условия протекания процесса; Тк — температура в реакционной камере; Тв — температура воспламенения обезвреживаемого компонента.
С увеличением времени протекания процесса, и интенсивности турбулентной диффузии степень окисления при неизменной температуре существенно увеличивается. Если же параметры А и t постоянны, то увеличения степени обезвреживания можно достигнуть только за счет повышения температуры в камере.
Индивидуальные свойства окисляемого компонента учитывается введением температуры воспламенения обезвреживаемого компонента. При использовании уравнения (3.67) следует учитывать, что реакции окисления многих веществ (например, углеводородных соединений) проходят с образованием промежуточных, менее активных соединений. В этих случаях в уравнение вводят температуру воспламенения именно этого соединения.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|