
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Адсорбция
3.6.2 Адсорбция
Общие сведения адсорбционной очистки газов. Поглощаемое из газовой фазы вещество в процессе адсорбции называется адсорбтивом, а твердое вещество, на поверхности которого или в порах которого происходит адсорбция поглощаемого вещества, называется адсорбентом. Газовая фаза, в которой находится извлекаемый компонент, называется газом носителем, а после того как извлеченный компонент перешел в адсорбированное состояние, его называют адсорбатом.
Явление адсорбции обусловлено наличием сил притяжения между молекулами адсорбента и адсорбтива на границе раздела соприкасающихся фаз. Процесс перехода молекул адсорбтива из газа носителя на поверхностный слой адсорбента происходит в том случае, если силы притяжения адсорбента превосходят силы притяжения, действующие на адсорбтив со стороны газа носителя.
Рассмотрим схему кристаллической решетки твердого тела (типа решетки - кубическая) (рис. 3.17). Атом «А», находящийся внутри кристалла, имеет шесть ближайших соседей, все его связи задействованы, и он не обладает свободной энергией. У атома «Б», находящегося на поверхности кристалла, только пять ближайших соседей, он имеет одну условную свободную связь и поэтому обладает большей энергией и находится в более высоком энергетическом состоянии, чем атом внутри кристалла. Еще большей энергией обладает атом «В», находящийся на грани кристалла. У него четыре ближайших соседа и, следовательно, большой избыток энергии. Самым большим избытком энергии обладает атом «Г», лежащий на вершине кристалла. У него всего три ближайших соседа (и три условно свободные связи). Этот избыток энергии называется поверхностной, и она является причиной адсорбции.
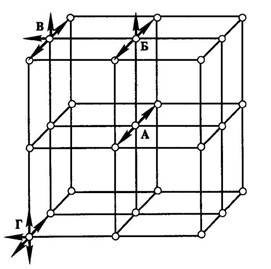
Рис. 3.17. Схема кристаллической решетки адсорбента
Молекулы адсорбированного вещества, переходя на поверхность адсорбента, уменьшают его энергию, в результате чего происходит выделение теплоты. Теплота физической адсорбции сравнительно невелика и составляет до 60 кДж/моль.
Силы притяжения адсорбента могут иметь различную природу — физическую или химическую. В соответствии с этим, различают физическую и химическую адсорбцию.
При физической адсорбции взаимодействие молекул с поверхностью адсорбента определяются сравнительно слабыми дисперсными, индукционными и ориентационными силами. При этом адсорбированные молекулы не вступают с молекулами адсорбента в химическое взаимодействие и сохраняют свою индивидуальность. Для физической адсорбции характерна высокая скорость, малая прочность связи между поверхностью адсорбента и адсорбтивом и малая теплота адсорбции. С повышением температуры количество физически адсорбированного вещества уменьшается, а увеличение давления приводит к возрастанию величины адсорбции.
Преимуществом физической адсорбции является легкая обратимость процесса. При уменьшении давления адсорбента в газовой смеси, либо увеличении температуры, адсорбируемые молекулы легко десорбируются без изменения химического состава, а регенерированный адсорбент может использоваться многократно.
Высокая скорость физической адсорбции и способность адсорбентов к регенерации позволяет вести процесс циклично в условиях обратимости, т. е. с чередованием стадий поглощения и выделения извлекаемых компонентов.
В основе химической адсорбции лежит химическое взаимодействие между адсорбентом и адсорбируемым веществом. Действующие при этом силы значительно больше, чем при физической адсорбции, а высвобождающееся при этом тепло совпадает с теплом химической реакции. Как правило, она колеблется в пределах от 20 до 400 кДж/моль. Из-за такой большой теплоты адсорбции энергия связи хемосорбируемых молекул сильно отличается от энергии связи этих же молекул в потоке газа. Соответственно, и энергия, необходимая для того, чтобы хемосорбированная молекула прореагировала с молекулой другого сорта, может быть существенно меньше, чем энергия, необходимая для реакции этих же молекул в газовой фазе. Этим объясняется тот факт, что адсорбированная на поверхности твердого тела молекула легче вступает в химическую реакцию с другими молекулами. Существует и другое важное отличие химической адсорбции: молекула абсорбтива, вступив в химическое взаимодействие, прочно удерживаются на поверхности и в порах адсорбента. Характерной особенностью химической адсорбции является и то, что скорость ее при низких температурах мала и возрастает с ростом температуры.
Адсорбция газов происходит в несколько стадий. Первой стадией является перенос молекул газа к внешней поверхности твердого вещества, и эта стадия аналогична диффузии молекул газа через стационарный слой к границе раздела фаз газ — жидкость при абсорбции. Вторая стадия адсорбции заключается в том, что молекулы газа проникают в поры твердого вещества, третьей стадией является собственно адсорбция молекулы в определенной области поры. Собственно адсорбция в порах протекает очень быстро по сравнению с двумя первыми стадиями.
Наибольшее значение для очистки газов имеет физическая адсорбция.
Скорость адсорбции. Скорость процесса адсорбции определяется скоростью подвода (диффузии) адсорбтива к внешней поверхности гранул адсорбента либо скоростью перемещения адсорбтива в порах адсорбента, либо зависит от обеих этих стадий. Скорость подвода адсорбтива к внешней поверхности адсорбента зависит от скорости газа-носителя, температуры, коэффициента диффузии адсорбтива в газе-носителе, вязкости и плотности среды. Скорость перемещения адсорбтива внутри гранул зависит от размера гранул адсорбента, диаметра пор, размеров молекулы адсорбтива, температуры и других факторов.
Характер протекания процессов адсорбции зависит от того, как протекает процесс — периодически или непрерывно. Периодические процессы, как правило, проводят с неподвижным слоем адсорбента, а непрерывные — с движущимся или кипящим слоем.
С повышением температуры количество адсорбированного вещества уменьшается. Процесс адсорбции в этих условиях графически выражается изобарой адсорбции, показывающей изменение количества адсорбированного вещества a в зависимости от температуры при постоянном давлении. С повышением концентрации адсорбтива над поверхностью адсорбента, при постоянной температуре, активность адсорбента увеличивается. Однако это увеличение продолжается лишь до определенного момента, когда наступает полное насыщение адсорбента, т. е. когда достигается максимальная поглотительная емкость адсорбента. Любые твердые вещества обладают поверхностью и, следовательно, потенциально являются адсорбентами. В технике, однако, используют адсорбенты с сильно развитой внутренней поверхностью, образование которой достигается в процессе их синтеза или в результате специальной обработки.
Одними из основных свойств адсорбентов является динамическая емкость (время защитного действия), размеры пор и избирательность адсорбентов.
Адсорбционная емкость адсорбентов. Различают статическую и динамическую емкость адсорбентов. Статическая емкость соответствует равновесному состоянию системы. Она показывает, какое количество вещества способен адсорбировать адсорбент в условиях равновесия, т. е. когда концентрация адсорбтива на входе и на выходе становится одинаковой. Динамическая емкость адсорбента соответствует поглощению вещества слоем адсорбента от начала адсорбции до начала «проскока» адсорбтива, т. е. когда в выходящем из слоя адсорбента газе-носителе появляются следы адсорбтива.
Так как концентрация адсорбтива в газе-носителе обычно выражается в граммах на литр, граммах на моль, парциальным давлением в паскалях, либо отношением парциального давления к давлению насыщенного пара (P/PS), то адсорбционная емкость (активность) может быть выражена в граммах поглощенного вещества на 100 г адсорбента или моль на грамм, сантиметр кубический на грамм, процент по массе и др.
Адсорбционная емкость адсорбента зависит от его природы. Она возрастает с увеличением поверхности, пористости, снижением размеров пор адсорбентов, а также с повышением концентрации адсорбтива в газе-носителе и давления в системе. С увеличением температуры и влажности адсорбционная емкость адсорбентов снижается. Поэтому перед использованием их подвергают прокалке (просушке), а процесс десорбции ведут при почти таких же температурах и давлениях.
Важно, чтобы адсорбент после длительной работы не терял свою активность и мог адсорбировать такое же количество вещества, как и в начале процесса. Хорошие адсорбенты выдерживают несколько сотен и тысяч циклов адсорбция-десорбция без существенной потери активности.
Пористая структура адсорбентов. Поверхность адсорбентов формируется за счет формы каркаса, из которого построено пористое тело. Различают внешнюю и внутреннюю поверхности. Внешняя поверхность зависит от количества макропор. Она невелика и составляет 0,5–2 м2/г, т. е. 0,2–0,5% от общей поверхности адсорбента. Внутренняя поверхность образуется за счет стенок микропор и средних пор в зависимости от их объема и размеров может достигать 500–1000 м2/г.
Поры адсорбентов образуются за счет пустот между частицами, из которых построен каркас пористого тела. Эти частицы могут иметь форму шара, эллипса, цилиндра, волокон и т. д.
Поры в твердых телах подразделяются на: макропоры с радиусом более 10–20 мкм и микропоры с радиусом до 150 мм. Макропоры, с размерами пор более 10–20 мкм, оказывают небольшое влияние на статистику адсорбции, но являются транспортными каналами для подвода адсорбируемых молекул к мезопорам и микропорам. В макропорах и мезопорах наблюдается послойный механизм адсорбции, в то время как в микропорах, размер которых соизмерим с размерами адсорбируемых молекул, адсорбция носит характер объемного заполнения. Поэтому для микропористых адсорбентов объем пор, а не поверхность адсорбента, играет решающее значение в адсорбционных процессах.
Адсорбент с крупными порами лучше адсорбирует вещества с большими размерами молекул и при больших давлениях. Среднепористый адсорбент эффективнее адсорбирует при средних давлениях, а мелкопористый — при низких давлениях. Энергия адсорбции в микропорах значительно выше, чем в макропорах и переходных порах. Это объясняется тем, что адсорбированные молекулы, размер которых соизмерим с размером пор адсорбента, взаимодействуют с обеими стенками поры, выделяя при этом больше тепла, чем при адсорбции молекул одной стороной стенки. Удельный объем микропор в адсорбентах достигает 0,2–0,6 см3/г, а удельная поверхность — до 500 м2/г и более. В связи с этим, микропоры играют основную роль при разделении газовых смесей, особенно при очистке газов от малых концентраций примесей.
Избирательность адсорбентов. Избирательность адсорбентов — это способность адсорбировать из газовых смесей индивидуальные вещества с определенными физико-химическими свойствами. Избирательность адсорбентов значительно зависит от их структурных свойств, так как именно от размера пор зависит их способность адсорбировать молекулы различной величины. Если средний радиус пор значительно больше радиуса адсорбируемых молекул, то такие поры могут лишь частично адсорбировать указанные молекулы. Эффективная адсорбция может быть лишь в том случае, когда средний радиус пор имеет тот же порядок, что и адсорбируемые молекулы.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|