
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Орбитали в атомах элементов первых трех периодов заполняются электронами в порядке увеличения их энергии.
Орбитали в атомах элементов первых трех периодов заполняются электронами в порядке увеличения их энергии.
В атоме не может быть двух электронов, у которых все четыре квантовых числа охарактеризованы одинаковыми значениями, так гласит принцип австрийского ученого Вольфганга Эрнста Паули.

Хотя бы одним значением квантового числа электроны должны отличаться. Из этого принципа следует следствие: на каждой орбитали максимально может находиться не более двух электронов, причём с противоположными спинами.
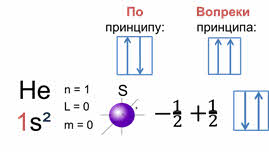
В качестве примера рассмотрим электронную формулу атома гелия – один эс два. Главное квантовое число, которого равняется одному, значит, побочное квантовое число будет равняться нулю, и соответственно всего один подуровень эс и одна орбиталь в форме сферы. Магнитное орбитальное квантовое число также равно нулю, так как оно равно сумме значений положительного отношения один к двум и отрицательного отношения один к двум. А эс подуровень атома гелия заполняется всего двумя электронами. Поскольку на первом электронном слое могут находиться максимально только два электрона, то этот слой в атоме гелия является завершённым и, следовательно, очень устойчив.

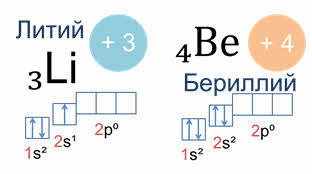
У атомов элементов второго периода начинает заполняться второй энергетический уровень, на котором может находиться максимально восемь электронов.
Так у атомов лития и бериллия электронами заполняется только два эс орбиталь.
А у атома бора пятый электрон уже занимает одну из трёх два пэ орбиталей. Вот так выглядят электронная и электронно-графическая формулы атома бора.
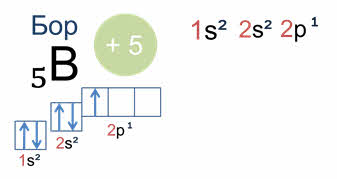
Подуровень два пэ изображён вплотную к подуровню два эс, но несколько выше. Тем самым подчёркивается его принадлежность к одному и тому же уровню и одновременно больший запас энергии.
Домашнее задание
Составить электронную формулу элементов 2 периода
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|