
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Конспект урока Электронные конфигурации атомов
Конспект урока "Электронные конфигурации атомов"
Общее число электронов равно заряду ядра атома, числу протонов в нем и соответственно атомному номеру элемента.
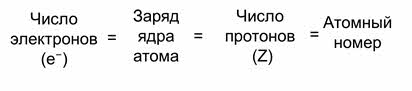
Например, у водорода атомный номер один, значит заряд ядра атома тоже плюс один, а протонов и электронов по одному.

Распределение электронов происходит в зависимости от энергии по энергетическим уровням, письменное выражение которых называется электронной формулой или электронной конфигурацией атома.
Например, у лития, элемента с атомным номером три, электронная конфигурация один эс два два эс один.

В этой конфигурации цифрой слева записывается номер энергетического уровня, затем следует буква, обозначающая подуровень, и, наконец, цифра вверху справа указывает число электронов на этом подуровне.
Схематически электронное строение атома изображается с помощью электронно-графической схемы. Электронно-графическая схема атома лития:
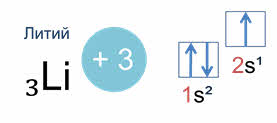
Орбитали обозначаются клеточками, а электроны стрелочками. На первом энергетическом уровне на эс орбитали находятся два спаренных электрона, а на втором уровне на эс орбитали только один неспаренный электрон.
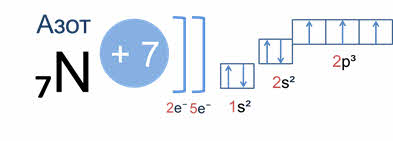
По принципу минимальной энергии, электрон занимает тот энергетический уровень, тот подуровень или ту атомную орбиталь, которым соответствует минимальный запас энергии. Это значит, что вначале заполняются те уровни, подуровни и орбитали, которые находятся ближе к ядру.
Например, у атома азота вначале заполняется одна эс орбиталь первого энергетического уровня двумя электронами, а затем второго энергетического уровня два эс орбиталь – двумя электронами и два пэ орбиталь того же уровня – тремя электронами.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|