
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная работа № 11.. Установка нормальности раствора NaOH по щавелевой кислоте.. Э кислоты = =126,0 : 2= . (разделить)
Лабораторная работа № 11.
Установка нормальности раствора NaOH по щавелевой кислоте.
1. Приготовление 1000 мл щёлочи приближённой 0,1 н. (нормальная концентрация). Рассчитайте количество щёлочи (NaOH) в г. При расчётах используют нормальную концентрацию растворов
нормальная N = 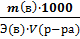 ;
;
Грамм – эквивалент Э (г-экв) – это количество вещества в граммах, эквивалентное одному атому или иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Э кислоты =  ; Э соли =
; Э соли = 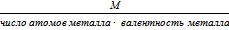
* Э основания = 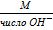 Э (NaOH) =
Э (NaOH) = 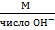 = ...... (рассчитать)
= ...... (рассчитать)
* m(в) = 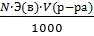 ; m(в) =..... (рассчитать)
; m(в) =..... (рассчитать)
Необходимо брать на 1 г больше. Едкие щёлочи жадно поглощают из воздуха влагу и углекислый газ.
2. Приготовление 250мл точно 0,1н раствора щавелевой кислоты (Н2С2О4• 2Н2О) . Рассчитайте количество кислоты.
* Э кислоты = =126,0 : 2= ... (разделить)
* m(в) = 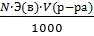 ; m(в) =..... (рассчитать)
; m(в) =..... (рассчитать)
Вычисленную навеску возьмите на аналитических весах на часовом стекле и через воронку без потерь перенесите в мерную колбу, тщательно смойте с часового стекла и воронки оставшиеся кристаллики кислоты дистиллированной водой в ту же колбу, перемешайте до растворения, долейте до метки.
3. Титрование.Прежде чем приступить к титрованию следует подобрать индикатор. Титровать будете слабую кислоту сильной щёлочью.
H2C2O4+2NaOH=Na2C2O4+2H2O
Вследствие гидролиза образовавшейся соли при реакции нейтрализации в момент эквивалентности среда будет щелочная. Поэтому индикатор *(какой?) .....
Тщательно вымытую бюретку сполосните рабочим раствором щёлочи и им же заполните её, следите, чтобы и капилляр бюретки был заполнен раствором. Установите мениск на нулевом делении бюретки, держа глаз на уровне мениска.
В чистую коническую колбу внесите 2 мл раствора кислоты, добавьте 1 каплю индикатора 1%-ного раствора и начинайте титровать - приливать в колбу с щавелевой кислотой понемногу раствор щёлочи из бюретки, непрерывно размешивая жидкость в колбе плавным движением. Титруйте до устойчивого розово-малинового цвета от одной капли. Повторите три раза. Данные запишите в таблицу. Рассчитайте по среднему значению объёма.
|
№ титрования
|
Раствор щавелевой кислоты |
Раствор щёлочи | ||||
| V1 (мл) | N1 | V2 (мл) | N2 | |||
| 1. | 2 | 0,1 | 1,8 | V1∙ N 1= V 2∙N1 * N2=.... | ||
| 2. | 2 | 0,1 | 1,7 | |||
| 3. | 2 | 0,1 | 1,9 | |||
| Среднее значение объёма раствора щёлочи | * .... | |||||
|
| ||||||
В основа расчёта -закон эквивалентов: отношение объёмов реагирующих веществ обратно пропорционально их нормальностям.
Отчёт сдать. ( записать кратко, * чётко)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|