
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
записать)ОБЪЁМНЫЙ ИЛИ ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ.
(записать)ОБЪЁМНЫЙ ИЛИ ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ.
Суть. Определение компонентов в исследуемом образце осуществляется точным измерением объёмов растворов двух веществ, вступающих между собой в реакцию и концентрация одного обязательно известна.
Раствор с известной концентрацией называют стандартным или титрованным.
Раствор с неизвестной концентрацией называют анализируемым.
Титрование - процесс добавления титрованного раствора каплями из бюретки к определённому объёму исследуемого раствора до окончания реакции. Момент окончания реакции - точка эквивалентности. Точку фиксируют с помощью индикатора или по изменению окраски реагирующих веществ.
Метод нейтрализации применяется в мясной промышленности при определении свежести мяса животных, качества жиров, качества кормовой муки, в молочной промышленности – при определении качества молока и молочных продуктов.
В основе метода лежит реакция нейтрализации, то есть реакция взаимодействия кислоты с основанием: Н+ + ОН- 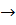 Н2О
Н2О
Данный метод применяется, главным образом, для количественного определения кислот и щелочей.
Растворы применяемые при нейтрализации, бесцветны, реакция нейтрализации не сопровождается внешними эффектами, поэтому для фиксирования точки эквивалентности, применяют индикаторы. Выбор индикатора.
| индикатор | Цвет в кислой среде | Цвет в щелочной среде | Область перехода | Показатель титрования |
| Метиловый оранжевый | розовый | жёлтый | 3,1-4,4 | 4 |
| Метиловый красный | красный | жёлтый | 4,2-6,2 | 5 |
| лакмус | красный | синий | 5,0-8,0 | 7 |
| фенолфталеин | бесцветный | малиновый | 8,2-10,0 | 9 |
Исходя из основного уравнения нейтрализации Н + ОН- 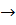 Н2О в момент эквивалентности казалось бы , должна быть нейтральная среда. Однако, в результате гидролиза образующейся соли, точка эквивалентности не всегда совпадает с точкой нейтральности
Н2О в момент эквивалентности казалось бы , должна быть нейтральная среда. Однако, в результате гидролиза образующейся соли, точка эквивалентности не всегда совпадает с точкой нейтральности
Возможны три случая титрования кислот и оснований:
1.Нейтрализация сильного основания слабой кислоты и наоборот, слабой кислоты сильным основанием
2NaOH + H2C2O4 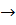 Na2C2O4 + 2H2O
Na2C2O4 + 2H2O
Вследствии гидролиза соли Na2C2O4 среда раствора в момент эквивалентности будет щелочная (рН > 7 ), следовательно, нужен фенолфталеин.
2.Нейтрализация сильной кислоты слабым основанием и, наоборот, слабого основания сильной кислоты
HCl + NH4OH 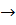 NH4Cl + H2O
NH4Cl + H2O
Вследствие гидролиза соли NH4Cl среда раствора в момент эквивалентности будет кислая(рН < 7), следовательно нужен метиловый оранжевый или метиловый красный.
3.Нейтрализация сильной кислоты сильным основанием и наоборот
NaOH + HCl 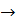 NaCl + H2O
NaCl + H2O
Образующая соль гидролизу не подвергается, среда нейтральная . рН в точке эквивалентности равен 7. Можно применить любые индикаторы, рТ которых лежит в пределах 8 – 10.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|