
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Положительный спин электрона – это вращение электрона по часовой стрелки вокруг собственной оси. Обозначается – ↑.
*Положительный спин электрона – это вращение электрона по часовой стрелки вокруг собственной оси. Обозначается – ↑.
*Отрицательный спин электрона – это вращение электрона против часовой стрелки вокруг собственной оси. Обозначается – ↓.
12. Физический смысл атомного (порядкового) номера – атомный (порядковый) номер химического элемента показывает заряд ядра атома, т.е. количество протонов в ядре, а т.к. атом электронейтрален, то и количество электронов в электронной оболочке атома.
13. Физический смысл номера периода – номер периода показывает количество энергетических уровней (электронных слоев) в электронной оболочке атома данного химического элемента.
14. Физический смысл номера группы – номер группы показывает:
а) количество валентных электронов в электронной оболочке атома данного химического элемента;
б) высшую валентность химического элемента, находящегося в главной подгруппе, исключение: F, O, N.
15. Химический элемент (с позиции ТСА) – это определенный вид атомов, имеющих одинаковый положительный заряд ядра (равное число протонов в ядре) и обладающие только своей совокупностью свойств.
16. Изотопы(от греч. isos – равный, одинаковый и topos – место) – это разновидности атомов одного и того же химического элемента, имеющие одинаковый положительный заряд ядра, но разную атомную массу, по причине разного числа нейтронов в ядре. Данный термин используется только во множественном числе.
17. *s-семейство – это семейство химических элементов, у которых на последнем энергетическом уровне электроны заполняют
s–подуровень (одну s-орбиталь). Это семейство образуют s-эле-менты, т.е. элементы І и ІІ главных подгрупп и гелий.
18. *p-семейство – это семейство химических элементов, у которых на последнем энергетическом уровне электроны заполняют
р-подуровень (три р-орбитали). Это семейство образуют р-эле-менты, т.е. элементы ІІІ–VIII главных подгрупп, кроме гелия.
19. *d-семейство – это семейство химических элементов, у которых на предпоследнем энергетическом уровне электроны заполняют
d–подуровень (пять d-орбиталей). Это семейство образуют d-эле-менты, т.е. элементы всех побочных подгрупп, кроме лантаноидов и актиноидов.
20. *f-семейство – это семейство химических элементов, у которых на предпредпоследнем энергетическом уровне электроны заполняют f–подуровень (семь f-орбиталей). Это семейство образуют f-эле-менты, т.е. лантаноиды и актиноиды.
21. **Квантовые числа – это численные характеристики электрона в атоме, которые описывают уровень энергии электрона, форму электронного облака и другие его свойства.
Бывают:
n – главное квантовое число;
l – орбитальное (побочное) квантовое число;
m – магнитное квантовое число;
ms – спиновое квантовое число
22. Радиоактивные элементы – это химические элементы, все изотопы которых обладают радиоактивностью. К ним относятся: технеций (43Тс), прометий (61Pm) и все элементы с атомного (порядкового) номера 84 и далее.
23. *Радиоактивность(от лат. radio – излучаю и activus – деятельный) –это самопроизвольное излучение заряжённых частиц неустойчивых ядер атомов, приводящее к их разрушению (распаду). Существует α-распад, β-распад, которые часто сопровождаются испусканием γ-лучей (γ-квантов). Скорость радиоактивного распада характеризуется периодом полураспада.
24. **Период полураспада – это время, за которое количество нестабильных частиц уменьшается наполовину. Является одной из основных характеристик радиоактивных изотопов, неустойчивых элементарных частиц. Обозначается Т½.
25. Радиоактивные нуклиды (радионуклиды) – это неустойчивые, самопроизвольно распадающиеся нуклиды химических элементов. Известны радиоактивные нуклиды всех химических элементов. В природе существует около 50 естественных радионуклидов и около 1500 ещё получено искусственно.
Например: нуклид водород-3 или тритий обозначают 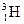 или Т в отличие от протия (водород-1) и дейтерия (водород-2) обладает радиоактивностью (Т½=12,26 лет).
или Т в отличие от протия (водород-1) и дейтерия (водород-2) обладает радиоактивностью (Т½=12,26 лет).
26. *Ядерная реакция – это процесс превращения атомов одного химического элемента в атомы других химических элементов, в результате изменения строения ядра атома. Бывают цепными и нецепными, а также деления (распада) и синтеза.
27. **Радиационная химия – это область химической науки, которая изучает химические превращения под действием ионизирующих излучений: α-, β-частиц, γ-излучения, нейтронов, протонов и других частиц. Под воздействием излучений протекают многие химические реакции: окисление, полимеризация, радиолиз и др.
28. *α(альфа)-частица– это ядро атома гелия. Обозначается 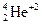 . Испускается при α-распаде радиоактивных изотопов различных элементов (226Ra, 222Rn, 238U и др.).
. Испускается при α-распаде радиоактивных изотопов различных элементов (226Ra, 222Rn, 238U и др.).
29. *β(бета)-лучи– это излучение, состоящее из электронов, испускаемое при β-распаде изотопов радиоактивных элементов. Их скорость близка к скорости света. Способны ионизировать газы, вызывать химические реакции, люминесценцию и т.д. Обозначается β–.
30. *γ(гамма)-лучи (γ-кванты)– это электромагнитное излучение с очень короткими длинами волн (менее 0,1 нм), испускаемое возбуждёнными ядрами атомов. Образуются при радиоактивных превращениях атомных ядер и при ядерных реакциях. В отличии от α-частиц и β-лучей не отклоняются в электрическими и магнитными полями и характеризуются большой проникающей способностью.
ЗАКОНЫ:
1. **Принцип наименьшей энергии – в невозбуждённом (нормальном или основном) состоянии атома электроны располагаются так, чтобы энергия атома была минимальной.
2. *Принцип (запрет) Паули (Швейцария, 1925 год) – в одном атоме не может быть двух электронов с одинаковым набором четырёх квантовых чисел (главного, орбитального, магнитного и спинового).
3. **Правило Клечковского(СССР, 1951 год) – в невозбуждённом состоянии атома электроны занимают подуровень с минимальным значением суммы главного (n) и орбитального квантовых (l) чисел, т.е. n + l . Если значения суммы квантовых чисел одинаковы, то сначала заполняется подуровень с минимальным значением главного квантового числа (n).
Например: у подуровней 3p (3+1) и 4s (4+0) сумма главного и орбитального квантовых чисел одинакова и равна 4, но первым будет заполняться подуровень 3p, т.к. у него меньше главное квантовое число – 3, а у 4s – 4.
4. *Принцип (правило) Хунда (Германия, 1927 год) – электроны в пределах одного подуровня располагаются по отдельным орбиталям так, чтобы их суммарный спин был максимальным.
РАСЧЕТНЫЕ ФОРМУЛЫ:
1. Формула нахождения числа протонов (Np+) в ядре и числа электронов (Ne-) на электронной оболочке:
Np+ = Ne- = Z,
где Z – атомный (порядковый) номер химического элемента.
2. Формула нахождения числа нейтронов (Nn°) в ядре: Nn° = A – Z = Ar – Z,
где А – массовое число ядра атома, которое приблизительно равно относительной атомной массе (Ar).
3. Формула нахождения максимального числа электронов на энергетическом уровне:
N = 2n2,
где n – номер энергетического уровня (главное квантовое число), n2 – максимальное число орбиталей на энергетическом уровне.
4. **Формула расчета средней относительной атомной массы природных изотопов:
Ar (Э) = A1 · W1+ A2 · W2 + A3 · W3 + …,
где A1, A2, A3 – массы изотопов, W1, W2, W3 – массовые доли изотопов в природе.
Например:
Задача: в природе распространено два изотопа хлора 35Cl и 37Cl, процентное содержание первого составляет 77,35 %, а второго – 22,65 %. Рассчитайте среднюю относительную атомную массу хлора.
| Дано: ω(35Cl) = 77,35 % ω(37Cl) = 22,65 % | Решение: Используя формулу: W(Э) = ω(Э) : 100 %, рассчитываем массовые доли изотопов: W(35Cl) = ω(35Cl) : 100 % = 77,35 % : 100 % = W(37Cl) = ω(37Cl) : 100 % = 22,65 % : 100 % = Подставляем полученные значения в формулу: Ar (Э) = A1 · W1+ A2 · W2 и рассчитываем среднюю относительную атомную массу хлора Ar (Cl) = 35 · 0,7735 + 37 · 0,2265 = 27,0725 +
Ответ: Ar (Cl) = 35,453
|
| Найти: Ar(Cl) = x |
ПЛАН-ХАРАКТЕРИСТИКА
ХИМИЧЕСКОГО ЭЛЕМЕНТА
1. Номер периода и его вид.
2. Номер группы, подгруппа.
3. Химический знак, атомный (порядковый) номер, массовое число атома (относительная атомная масса), ядро атома с его зарядом, энергетические уровни и подуровни.
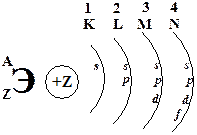
4. Число электронов на электронной оболочке, число протонов и нейтронов в ядре атома.
5. Распределение электронов на энергетических уровнях.
6. Электронная конфигурация атома.
7. Графическая конфигурация атома по квантовым ячейкам.
8. **Возможные валентности химического элемента (определяется по числу неспаренных электронов).
9. **Семейство химического элемента.
10. Формула высшего оксида данного химического элемента, его название и краткая характеристика.
11. Формула гидроксида, соответствующая высшему оксиду, его название и краткая характеристика.
12. Формула водородного соединения, его название.
Например: план-характеристика магния.
1) III (малый) период
2) II группа, главная подгруппа (или II-А)
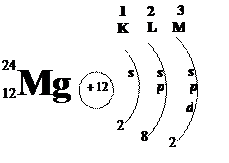 3), 5)
3), 5)
6) 1s2 2s22p6 3s23p03d0
 K L M
K L M
4) Ne-(Mg) = 12 – на электронной оболочке
Np+(Mg) = 12 – в ядре
Nn°(Mg) = 12 – в ядре
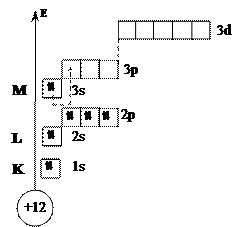 7)
7)
8) Val = 0 – невозбуждённое (нормальное) состояние атома
Val = II – возбуждённое состояние атома
9) s-семейство
10) MgO – оксид магния, солеобразующий, основный.
Получение: 2Mg + O2 → 2MgO
Свойство: MgО + 2HCl → MgCl2 + H2O
11) Mg(OH)2 – гидроксид магния, нерастворимое неамфотерное основание:
Получение:
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
Свойство:
Mg(OH)2 + 2HCl → MgCl2+ 2H2O
12) MgH2 – гидрид магния
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|