
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
СТРОЕНИЕ АТОМА
СТРОЕНИЕ АТОМА
ПОНЯТИЯ:
1. Атом – это нейтральная электронно-ядерная система, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки, заполненной электронами, число которых равно атомному (порядковому) номеру химического элемента. Ядро атома состоит из протонов и нейтронов, а электронная оболочка из энергетических уровней и подуровней.
2. Протон – это элементарная положительно заряженная частица, входящая в состав ядра атома. Обозначается р+. *Открыт Э. Резерфордом (Англия) в 1920 году.
3. Нейтрон – это элементарная нейтральная частица, входящая в состав ядра атома. Обозначается no. *Открыт Дж. Чедвиком (Англия) в 1932 году.
4. Нуклоны – это протоны и нейтроны ядра атома, связанные между собой ядерными силами.
5. Нуклид– это вид атома химического элемента с определённым значением массового числа, т.е. суммы чисел протонов и нейтронов в ядре.
Например: нуклид водород-1 обозначают 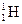 (т.е. атом водорода, в ядре которого содержится 1 протон и нет нейтронов), нуклид водород-2 –
(т.е. атом водорода, в ядре которого содержится 1 протон и нет нейтронов), нуклид водород-2 – 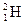 (т.е. атом водорода, в ядре которого содержится 1 протон и 1 нейтрон).
(т.е. атом водорода, в ядре которого содержится 1 протон и 1 нейтрон).
**В настоящее время известно более 2500 нуклидов
6. Массовое число ядра атома – это целое число, равное сумме протонов и нейтронов в ядре данного атома. Обозначается – А.
7. Электрон – это мельчайшая элементарная отрицательно заряженная частица, входящая в состав электронной оболочки атома. Обозначается е–. *Открыт Дж. Томсоном (Англия) и
Э. Вихертом (Германия) в 1897 году.
8. Валентные электроны – это электроны последнего энергетического уровня, которые участвуют или способны участвовать в образовании химических связей.
9. Электронная конфигурация атома – это распределение электронов в электронной оболочке атома по энергетическим уровням и подуровням.
10. *Электронная орбиталь – это область пространства, где нахождение электрона, при его вращении вокруг ядра атома, наиболее вероятно и максимально. Бывают:
s-орбиталь – имеет форму шара;
p-орбиталь – имеет форму «гантели или вытянутой восьмерки»;
d-орбиталь – имеет форму цветка;
f-орбиталь – имеет форму сложного цветка.
На любой орбитали не может быть более двух электронов с противоположными спинами.
11. *Спин(от англ. spin – крутиться, вращаться)электрона– это вращение электрона вокруг собственной оси при движении вокруг ядра атома. Бывает положительным и отрицательным.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|