
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ATOM ВОДОРОДА ПО ТЕОРИИ БОРА.. Основные формулы
§ 38. ATOM ВОДОРОДА ПО ТЕОРИИ БОРА.
Основные формулы
• Момент импульса электрона на стационарных орбитах *
L=mvr = nħ (n=1,2,3,…),
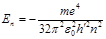 |
где т — масса электрона; r — радиус орбиты; v — скорость электрона на орбите; п — главное квантовое число; ħ — постоянная Планка.
• Энергия электрона, находящегося на n-й орбите,
где ε0 — электрическая постоянная.
• Сериальная формула, определяющая длину волны λ или частоту υ света, излучаемого или поглощаемого атомом водорода при переходе из одного стационарного состояния в другое,
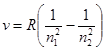
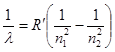
,
где R' и R —постоянная Ридберга (R'=1,097*107 м-1; R=cR'=3,29*1015 с-1); n1 и n2 — целые числа; n1 — номер серии спектральных линий (n1=l — серия Лаймана, n2=2 — серия Бальмера, n1=3 — серия Пашена и т. д.). Для данной серии n2=n1+l, n1+ 2, n1+3 и т. д.
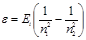
• Энергия фотона, испускаемого атомом водорода при переходе из одного стационарного состояния в другое,
где Ei — энергия ионизации * водорода: Ei=2πhħR=13,6 эВ.
 |
* Бор исходил из предположения, что электроны обращаются по круговым орбитам. Зоммерфельд дополнил теорию Бора введением эллиптических орбит. Современная физика отказалась от представления об электронных орбитах. Вместо орбит введено понятие об энергетических уровнях атома. При этом номера уровней совпадают с номерами боровских орбит. Однако в целях наглядности иногда пользуются термином «орбита». Подробнее см. § 47.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|