
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Таблица стандартных электродных потенциалов.
Таблица стандартных электродных потенциалов.
Для всех металлов стандартные электродные потенциалы найдены и составляют ряд стандартных электродных потенциалов (ряд активности, ряд напряжений – устаревш. Справедлив только для водных растворов!). На его основании составлена таблица – «Стандартные электродные потенциалы металлов».
Впервые она была составлена в 1886 году выдающимся химиком Н.Н. Бекетовым.
Таблица стандартных электродных потенциалов характеризует химическую активность металлов. В таблице выделяют три группы металлов (деление условное, зависящие от концентрации ионов металла в растворе):
1. очень активные металлы – от лития до алюминия;
2. металлы средней активности от цинка до водорода;
3. неактивные металлы, металлы стоящие за водородом.
Таблица обладает следующими свойствами:
1. чем меньше электродный потенциал металла, тем больше его восстановительная способность и тем активнее металл (восстановительная активность растет, ¯окислительная активность ионов уменьшается);
2. металлы, имеющие отрицательный электродный потенциал и стоящие в ряду напряжений до водорода, вытесняют его из разбавленных растворов кислот, кроме азотной кислоты;
3. каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые в ряду напряжений стоят после него.
Например, железо вытесняет медь из раствора хлорида меди:
Fe + CuCl2 = FeCl2 +Cu,
а медь вытесняет ртуть из раствора нитрата ртути:
Cu + Hg(NO3)2 = Hg + Cu(NO3)2
Для условий, отличных от стандартных (по концентрации раствора), величина электродного потенциала рассчитывается по формуле Нернста:
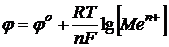
| где | jо – стандартный электродный потенциал (В); F – постоянная Фарадея (96500 Кл/экв); R – универсальная газовая постоянная (8,314 Дж/моль); T – фактическая температура (298 К); n – число электронов, принимающих участие в процессе; 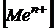 – концентрация (активность) ионов металла в растворе (моль/л) – концентрация (активность) ионов металла в растворе (моль/л)
|
Подставляя численные значения всех постоянных, получают более простой вид уравнения Нернста:
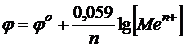
Пример. Цинковая пластинка погружена в 0,01 раствор её соли.
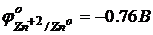
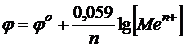
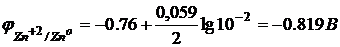
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|