
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Двойной электрический слой. Электродные потенциалы.
Двойной электрический слой. Электродные потенциалы.
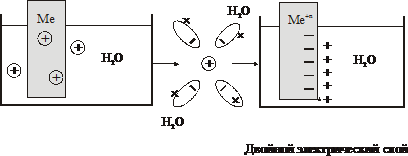
Особенность электрохимических реакций – это ОВР, протекающие в пограничной области металл (проводник)/раствор, т.е. на поверхности электродов (анода и катода), с участием электронов.
При погружении в воду или раствор соли металлической пластинки, то под действием полярных молекул воды, металл посылает в раствор электроны,
по схеме:
Мео – nē = Меn+
Меn+ + nē = Мео
С течением времени устанавливается динамическое равновесие:
Meо + m H2O 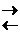 Me(H2O)mn+ + nē
Me(H2O)mn+ + nē
Или упрощенно Мео 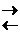 Меn++ nē
Меn++ nē
Выделяют два случая (для активных и малоактивных металлов):
1. активные металлы при погружении в растворы своих солей, даже незначительных концентраций, легко посылают ионы в раствор.
на примере цинковой пластинки 
| Znо – 2ē ® Zn2+ электрод/р-р электролита Электроны остаются на пластинке и заряжают ее «–», ионы цинка перешедшие в раствор заряжают жидкость «+». На границе раздела металлической пластинки (электрода) с раствором электролита, возникает двойной электрический слой толщиной 10–7 см с определенной разностью потенциалов. |
2. малоактивные металлы
на примере медной пластинки 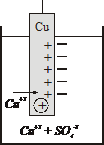
| Сu2+ + 2ē → Cuо из растворов легче переходят на пластинку (при этом происходит их восстановление) заряжая ее положительно, из-за избытка анионов раствор вокруг пластинки заряжается отрицательно. Образуется двойной электрический слой. |
Таким образом, разность потенциалов электрод/электролит называется электродным потенциалом (Е, j [В]). Он зависит от природы металла, концентрации его ионов и температуры.
Если концентрация ионов равна 1 моль/л при температуре 25 оС, то электродный потенциал обозначают jо и называют стандартным электродным потенциалом.
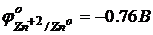
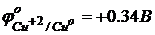 в числителе – окисленная форма, в знаменателе – восстановленная форма, знак соответствует возникающему на металле в двойном слое.
в числителе – окисленная форма, в знаменателе – восстановленная форма, знак соответствует возникающему на металле в двойном слое.
Абсолютное значение электродного потенциала определить невозможно, однако можно определить разность электродных потенциалов исследуемого металла и так называемого водородного электрода, электродный потенциал которого в стандартных условиях принят равным нулю.
Водородный электрод устроен следующим образом:
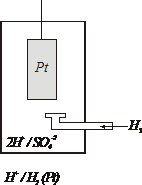
| Платиновая пластинка помещается в 1 М раствор серной кислоты. Снизу в раствор подается водород, который насыщает платину. При этом на её поверхности устанавливается равновесие Н2 – 2ē ⇄ 2Н+ Ввиду химической пассивности платины в данных условиях возникший электродный потенциал относится к водороду и обозначается |
Для определения значения потенциала металла собирают гальванический элемент из водородного электрода и испытуемого металла, погруженного в 1М раствор его соли. Разница электродных потенциалов испытуемого металла и водородного электрода принимается за электродный потенциал испытуемого металла.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|