
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Определение: Согласно теории Бренстеда кислотой является любое вещество, способное диссоциировать с отщеплением протона. Т.е. кислота – это донор протонов. Основанием является любое вещество, способное присоединять протон. Т.е. основание – это акцептор пр
Определение: Согласно теории Бренстеда кислотой является любое вещество, способное диссоциировать с отщеплением протона. Т.е. кислота – это донор протонов. Основанием является любое вещество, способное присоединять протон. Т.е. основание – это акцептор протонов.
Согласно теории Льюиса кислотой является любая молекула или частица, способная принимать электроны на вакантную орбиталь. Т.е. кислота – это акцептор электронов. Основанием является любая молекула или частица, способная быть донором электронов. Т.е. основание – это донор электронов.
Определение: Частица, образующаяся из кислоты после диссоциации и несущая отрицательный заряд - называется сопряженным основанием. Частица, образующаяся из основания после присоединения протона и несущая положительный заряд - называется сопряженной кислотой.
5.2.1. Кислоты Бренстеда
Характеристикой силы кислот, по отношению к воде, является константа диссоциации, являющаяся константой равновесия следующей реакции:
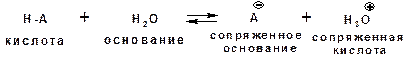
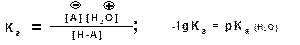
Наиболее известные примеры кислот в органической химии это карбоновые кислоты алифатические, например уксусная кислота:
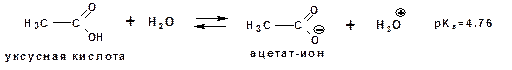
и бензойная:
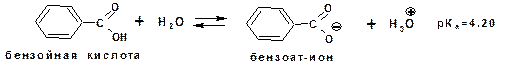
Карбоновые кислоты являются кислотами средней силы. В этом можно убедиться сравнивая значения рК карбоновых кислот и некоторых других приведенных ниже:
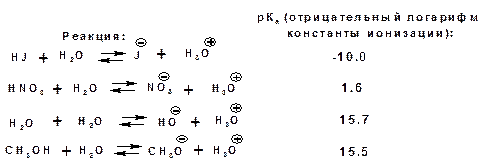
Отщеплять протон могут органические соединения, относящиеся к разным классам органических соединений. Среди органических соединений различают ОН-, SH-, NH- и СН-кислоты. К ОН-кислотам относятся карбоновые кислоты, спирты и фенолы. К NH-кислотам относятся амины и амиды. К СН-кислотам относятся нитроалканы, карбонильные соединения, сложные эфиры, терминальные алкины. В очень слабым СН-кислотам относятся алкены, ароматические углеводороды и алканы.
Сила кислоты тесно связана с устойчивостью сопряженного основания. Чем устойчивее сопряженное основание, тем более кислотно-основное равновесие смещено в строну сопряженных основания и кислоты. Стабилизация сопряженной кислоты может быть обусловлена следующими факторами:
Чем выше электроотрицательность атома, тем сильнее он удерживает он электроны в сопряженном основании. Например, рК фтористого водорода 3.17; рК воды 15.7; рК аммиака 33 и рК метана 48.
2. Стабилизация аниона по мезомерному механизму. Например, в карбоксилат-анионе:
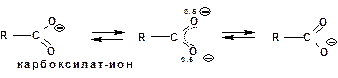
В алкоксид-ионе, например:
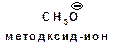
такая стабилизация невозможна. Соответственно для уксусной кислоты рК=4.76, рК метилового спирта 15.5.
Другим примером стабилизации сопряженного основания является фенолят-ион, образующийся в результате диссоциации фенола:
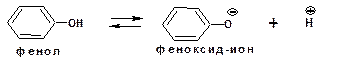
Для образовавшегося феноксид (или фенолят)-иона можно построить резонансные структуры, отражающие делокализацию отрицательного заряда по ароматическому кольцу:
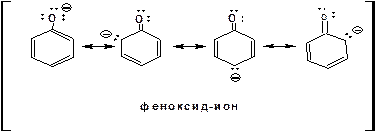
Соответственно рК фенола равно 9.98, а метанола, для которого невозможно построить резонансные структуры имеет рК фенола равное 15.5.
3. Введение электронодонорных заместителей дестабилизирует сопряженное основание и соответственно снижает силу кислоты:
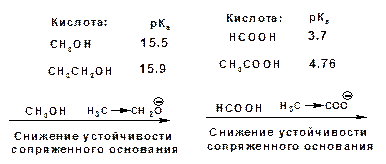
4. Введение электроноакцепторных заместителей стабилизирует сопряженное основание и повышает силу кислот:
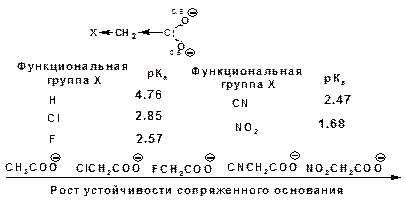
5. Удаление по цепи электроноакцепторного заместителя от протонодонорной группы ведет к снижению силы кислоты:
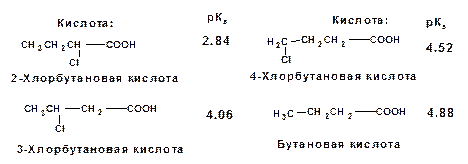
Приведенные данные иллюстрируют быстрое затухание индуктивного эффекта с увеличением углеводородной цепи.
Особое внимание следует уделить СН-кислотам, поскольку, образующиеся при их диссоциации сопряженные основания, в качестве которых выступают карбанионы. Эти нуклеофильные частицы являются промежуточными во многих органических реакциях.
СН-кислоты наиболее слабые из кислот всех типов. Продуктом кислотной диссоциации является карбанион – частица, в которой основой является атом углерода , несущий отрицательный заряд. Такая частица имеет тетраэдрическое строение. НЭП занимает sp3-гибридную орбиталь. Сила СН-кислоты определяется теми же факторами, чито и сила ОН-кислоты. Ряд стабилизирующего влияния заместителей совпадает с рядом увеличения их электроноакцепторных свойств:
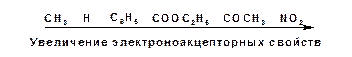
Среди СН-кислот особый интерес представляют аллил-анион и бензил-анион. Эти анионы можно представить в форме резонансных структур:
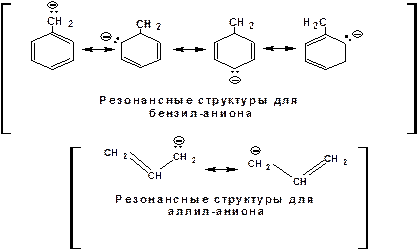
Эффект делокализации отрицательного заряда в бензил-анионе столь велик, что его геометрия приближается к плоской. При этом углеродный атом карбанионного центра меняет гибридизацию с sp3 на sp2.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|