
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Изменение свойств элементов в периодах
ГАОПУ 《 Бузулукский лесхоз – техникум 》
Самостоятельная работа 1
По химии: Благородные газы. Применение благородных газов. Закономерности в изменении свойств простых веществ, водородных соединений, высших оксидов и гидроксидов. Идентификация неорганических веществ и ионов.
Выполнила :
Студентка группы 1 А
Ефимова Ксения
Бузулук 2021
Периодичность означает повторение физических и химических свойств элементов и их соединений через определенные интервалы.
Например, щелочные металлы (элементы IА подгруппы) располагаются в таблице через каждые 8 или 18 элементов. Во всех атомах щелочных металлов на последнем электронном слое находится по 1 электрону, который они легко отдают, выступая в роли восстановителей. Элементы галогены располагаются в периодической системе в VIIА подгруппе, на внешнем слое в их атомах находится 7 электронов. Галогены – типичные неметаллы, сильные окислители, причем сходны состав и свойства образуемых ими не только простых, но и сложных веществ.
Следовательно, периодичность свойств элементов и их соединений обусловлена повторением электронных конфигураций атомов. В этом заключается физический смысл периодического закона.
Изменение свойств элементов в периодах
В периодах с увеличением заряда ядра происходит последовательное увеличение числа электронов на внешнем уровне и уменьшение радиусов атомов. Рис. 1.
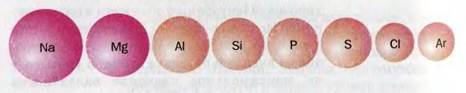
Рис. 1. Изменение радиуса атомов в периоде
Так как возрастает притяжение электронов к ядру, увеличивается относительная электроотрицательность. Металлические и восстановительные свойства простых веществ, образуемых атомами этих элементов, убывают, все труднее становится атомам отдавать электроны. Неметаллические и окислительные свойства нарастают (Таблица 1).
Таблица 1. Некоторые свойства элементов второго периода и образованных ими веществ
| Группа | I | II | III | IV | V | VI | VII | VIII |
| 1. Элемент, поряд. номер | 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne |
| 2. Строение внешнего энергетического уровня | 2s1 | 2s2 | 2s22p1 | 2s22p2 | 2s22p3 | 2s22p4 | 2s22p5 | 2s22p6 |
| 3. Радиус атома, нм | 0,159 | 0,104 | 0,078 | 0,062 | 0,052 | 0,045 | 0,040 | 0,035 |
| 4. Относительная электроотрицательность | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | - |
| 5. Свойства простого вещества | Щелочной металл | Металл | Неметалл | Неметалл | Неметалл | Активный неметалл | Очень активный неметалл | Благородный газ |
| 6. Окислительно-восстановительные свойства простого вещества | Сильный восстановитель | Восстановитель | Слабый окислитель | Слабый окислитель | Окислитель | Сильный окислитель | Очень сильный окислитель | Химически инертен |
| 7. Кислотно-основные свойства высших оксида и гидроксида | +1 Li2O основный оксид LiOH сильное основание | +2 BeO амфотерный оксид Be(OH)2 амфотерный гидроксид | +3 B2O3 кислотный оксид H3BO3 очень слабая кислота | +4 CO2 кислотный оксид H2CO3 слабая кислота | +5 N2O5 кислотный оксид HNO3 сильная кислота | ----- | ----- | ----- |
| 8. Свойства водных растворов газообразных водородных соединений | --- | --- | --- | СН4 безразличные | NH3 основные | H2O амфотерные | HF кислотные |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|