
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция 2.2. Классификация реакций по механизму разрыва связей
Лекция 2.2. Классификация реакций по механизму разрыва связей
Классификация реакций по механизму разрыва связей
Разрыв ковалентной связи может происходить двумя способами, обратными механизмам её образования.
1. Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим
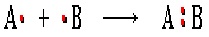
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами

Пример:
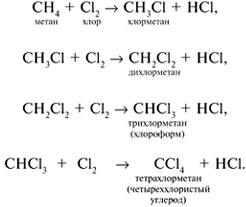
Условия проведения радикальных реакций:
•повышенная температура (часто реакцию проводят в газовой фазе),
•действие света или радиоактивного излучения,
•присутствие соединений – источников свободных радикалов (инициаторов), например, пероксидов ROOR.
•неполярные растворители.
2. Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
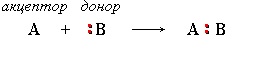
В результате образуются разноименно заряженные ионы – катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион – карбанионом.
Органические катионы и анионы – неустойчивые промежуточные частицы. В отличие от неорганических ионов, постоянно присутствующих в водных растворах и расплавах, они возникают только в момент реакции и сразу же вступают в дальнейшие превращения.
Условия ионных реакций:
o невысокая температура;
o полярные растворители, способные к сольватации образующихся ионов.
Действие света или радиоактивного излучения не влияет на скорость ионных реакций.
По характеру реагента, действующего на молекулу, ионные реакции делятся на электрофильные и нуклеофильные
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|