
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
IV. с водой образуется соответствующий гидроксид, если основной оксид-основание, если кислотный-кислота(посмотреть в таблицу растворимости - если гидроксид не растворимый реакция не идет). I. Основания. П. Кислоты
⇐ ПредыдущаяСтр 2 из 2
IV. с водой образуется соответствующий гидроксид, если основной оксид-основание, если кислотный-кислота(посмотреть в таблицу растворимости - если гидроксид не растворимый реакция не идет)
| Na2O+HOH = 2NaOH BaO+2HOH = Ba(OH)2 | ВеО+НОН 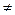 ZnO+HOH
ZnO+HOH 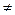
| SO2+ НОН = H2SO3
SiO2 + НОН 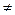
|

I. Основания
| растворимые | амфотерные | нерастворимые |
| 1. С кислотами 2NaOH+H2SO4—>Na2SO4+2H2O 2.С кислотными оксидами(подбираем соответствующую кислоту) SОз + Ва(ОН)2— >BaSO4↓+H2O [HaSO4] 3.С солями. Условия:а)посмотреть в таблицу растворимости-оба исходных вещества должны быть растворимые б)должен образоваться осадок 2NaOH+CuSO4 =Cu(OH)2↓+Na2SO4 Ba(OH)2+Na2SO4 = BaSO4↓+Na2SO4 | 1. С кислотами (ведут себя как основания) H2SO4+Zn(OH)2↓ = ZnSO4+2H2O 2.Со щелочами (ведут себя как кислоты) а) при нагревании образуются цинкаты 2NaOH+Zn(OH)2↓→ t Na2ZnO2+2H2O [H2ZnO2] б) в растворе образуется комплексное соединение 2NaOH( р-р.)+Zn(OH)2→Na2[Zn(OH)4] 3. Разлагаются 2А1(ОН)з↓ = А12Оз+ЗН2О 4.С солями не реагируют | 1. С кислотами (кроме Н2SiOз) Си(ОН)2↓+2НС1 = СиCl2 +2H2O 2. Разлагаются Cu(OH)2↓ = CuO+H2O Zn(OH)2↓ = ZnO+H2O |
П. Кислоты
| растворимые | нерастворимые |
1. С металлами:
Условия:
а) Посмотреть в электрохимический ряд напряжения металл должен; находиться до водорода
б) Посмотреть в таблицу растворимости - осадка быть не должно.
 Mg+2HCl = MgCl2+H2↑
{РЬ}+Н2SО4 Mg+2HCl = MgCl2+H2↑
{РЬ}+Н2SО4 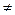 {РЬSО4↓}+Н2↑
( осадок)
2.С основаниями (растворимыми и нерастворимыми) 2NaOH+H2SO4 = Na2SO4+2H2O Cu(OH)2↓+H2SO4 = CuSO4+2H2O
3.С основанными оксидами
H2SO4+BaO = BaSO4↓+H2O
4.С солями (кроме Н2SiOз)
Условия:(посмотреть в таблицу растворимости — должен образоваться осадок, газ или малодиссоциирующее вещество)
H2SO4+BaCl2 = BaSO4↓+2HCl H2SO4+CaCO3↓ = CaSO4+CO2↑ + H2O {РЬSО4↓}+Н2↑
( осадок)
2.С основаниями (растворимыми и нерастворимыми) 2NaOH+H2SO4 = Na2SO4+2H2O Cu(OH)2↓+H2SO4 = CuSO4+2H2O
3.С основанными оксидами
H2SO4+BaO = BaSO4↓+H2O
4.С солями (кроме Н2SiOз)
Условия:(посмотреть в таблицу растворимости — должен образоваться осадок, газ или малодиссоциирующее вещество)
H2SO4+BaCl2 = BaSO4↓+2HCl H2SO4+CaCO3↓ = CaSO4+CO2↑ + H2O
| 1.Со щелочами, т.е. растворимыми основаниями 2NaOH+.Н2SiOз.→ t Na2SiOз+2H2O Н2SiO+ 2NaOH = Na2SiOз+2H2O 2.Разлагаются Н2SiOз↓ = Н2О+SiO2 |
IП. Соли
| Средние Na2SO4 –сульфат натрия, Na3PO4 фосфат натрия | Основные CuOHCl-гидроксихлорид натрия, (CaOH)2SO4 | Кислые NaHSO4-гидросульфат натрия, Na2HPO4- гидрофосфат натрия, NaH2PO4- дигидрофосфат натрия | Комплексные Na[Al(OH)4]-тетрагидроксиалюминат натрия, Na3[Fe(CN)6]-гексацианоферрат натрия |
Соли
| растворимые | нерастворимые |
| 1. С металлами Условия: а) посмотреть в электрохимический ряд напряжения, каждый впереди стоящий металл вытесняет последующий б) посмотреть в таблицу растворимости - исходная соль должна быть растворимой, осадка не должно получиться Mg+ CuCl2 = MgCl2+Cu↓ 2.Со щелочами Условия: а) посмотреть в таблицу растворимости – и основание и исходная соль должны быть растворимые б) посмотреть в таблицу растворимости –должен образоваться осадок, газ или малодиссоциирующее вещество) 2.NaOH+CuCl2 = Cu(OH)2↓+2NaCl 3.С кислотами Условия: (посмотреть в таблицу растворимости -должен быть осадок, газ или малодиссоциирующее вещество) BaCl2+H2SO4 = 2HCl+BaSO4↓ СаСОз+Н2SО4 = СаSО4+Н2О + CO2↑ 4.С солями Условия: а) посмотреть в таблицу растворимости –обе исходные соли должны быть растворимые б) посмотреть в таблицу растворимости – должен образоваться осадок или малодиссоциирующее вещество) BaCl2+Na2SO4 = BaSO4↓+2NaCl | 1.Разлагаются СаСОз = СаО+СО2↑ 2.С кислотами СаСОз+Н2SО4 = СаSО4+Н2О + CO2↑ |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|