
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
I. С водой
Стр 1 из 2Следующая ⇒

I. С водой
а) посмотреть в электрохимический ряд напряжения - металл должен быть в электрохимическом ряду до водорода;
б) посмотреть в таблицу растворимости – если гидроксид растворимый, образуется основание. Если гидроксид не растворимый, образуется оксид-при нагревании
| 2Na+2H2O = 2NaOH+H2↑ получается гидроксид | Zn+ H2O → t ZnO + H2↑ получается оксид | Си+ H2O 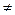 не реагируют не реагируют
|
II. С кислотой:
а) посмотреть в электрохимический ряд напряжения - металл должен быть до водорода;
б) посмотреть в таблицу растворимости - осадка быть не должно
| Активные металлы с кислотой не берут, т.к. они очень активные и будут реагировать с водой | Образуется соль и водород
Mg + 2HCl = МgCl + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
{РЬ}+Н2SО4 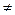 {РЬSО4↓}+Н2↑ {РЬSО4↓}+Н2↑
| Не вступают в реакцию
Cu+HCl 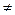 Ag+H2SO4
Ag+H2SO4 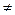
|
Ш. С солями:
а) посмотреть в электрохимический ряд напряжения - каждый впереди стоящий металл вытесняет последующий;
б) посмотреть в таблицу растворимости - осадка быть не должно
| Для реакций замещения в растворах активные металлы не берут, т.к. они очень активные и будут реагировать с водой 2H2O + 2Na=2NaOH +H2 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 CuSO4+Na ≠ Na2SO4+Cu ↓ | Образуется соль и металл
CuSO4+Zn = ZnSO4+Cu ↓
CuSO4+Ag 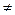
| 2AgNO3+Cu = Cu(NO3)2+2Ag ↓ |


| Nа+2O, Ва+2О 1.С кислотами ВаО+2НС1 = ВаС12+Н2О 2.С кислотными оксидами (подбираем соответствующую кислоту) СаО+СО2 = СаСОз [Н2СОз] 3. С водой ВаО+ Н2О =Ва(OH)2 | Zn+2O, Be+2O, Аl+3Оз, Сr+3 2Оз 1.Как основной оксид а)с кислотой ZnO+H2SO4 = ZnSO4+H2O б) с кислотным оксидом ZnO+SO2 = ZnSO3 б) Как кислотный а)со щелочами ZnO+2NaOH = Na2ZnO2+H2O (H2ZnО2) 2NaOH( р-р.)+ZnO +H2О→Na2[Zn(OH)4] б) с основными оксидами ZnO + Na2О = Na2ZnO2 | S+4O2, P+52O5, S+6Оз, Сr+6Оз 1. с основаниями(подбираем соответствующую кислоту) . С водой +2NaOH = Na2SO3+H2O (H2SO3) 2. с основными оксидами (подбираем соответствующую кислоту) P2O5 + 3Na2O = 2Na3PO4 (НзРО4) 3. . С водой. SO3+ Н2О= H2SO4 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|