
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с м
* Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Окисление в кислой среде:
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с кислым раствором дихромата калия. Оранжевая окраска гидратированного иона Cr2O72- исчезает и появляется зеленоватая окраска, характерная для иона Cr3+ . Эта смена окраски позволяет определять даже следовые количества спиртов.
CH3- OH + K2Cr2O7 + 4H2SO4 → CO2 + K2SO4 + Cr2(SO4)3 + 6H2O
3CH3-CH2-OH + K2Cr2O7 + 4H2SO4 → 3CH3COH + K2SO4 + Cr2(SO4)3 + 7H2O
В более жёстких условиях окисление первичных спиртов идёт сразу до карбоновых кислот:
3CH3-CH2-OH + 2K2Cr2O7 + 8H2SO4 t→ 3CH3COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O
* Третичные спирты устойчивы к окислению в щелочной и нейтральной среде. В жёстких условиях (при нагревании, в кислой среде) они окисляются с расщеплением связей С-С и образованием кетонов и карбоновых кислот.
В нейтральной среде:
CH3 – OH + 2KMnO4 →K2CO3 + 2MnO2 + 2H2O, а остальные спирты до солей соответствующих
карбоновых кислот.
2.2 Горение (с увеличением массы углеводородного радикала – пламя становится всё более коптящим) CnH2n+1-OH + O2 t → CO2 + H2O + Q
2.3. Окисление (мягкое, до альдегидов).
СH3-CH2-OH + CuO 300°,Cu → CH3-C=O + Cu + H2O
│
H
(ацетальдегид – запах листвы)
Это качественная реакция на первичные спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный запах ацетальдегида – запаха зелёной листвы).
3. Реакции отщепления ( элиминирования).
3.1. Внутримолекулярнаядегидратация ( - H2O)
CH3-CH2-CH(OH)-CH3 t>140,H2SO4(к)→ CH3-CH=CH-CH3 + H2O
бутанол-2 бутен-2
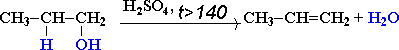
В тех случаях, когда возможны 2 направления реакции, например:
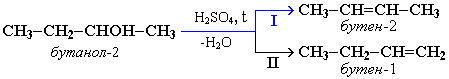
дегидратация идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена. Правило Зайцева: Водород отщепляется от наименее гидрированного атома углерода соседствующего с углеродом, несущим гидроксил.
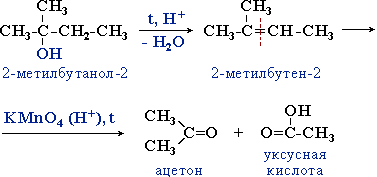
3.2. Межмолекулярная дегидратация
2C2H5OH t<140,H2SO4(к)→ С2H5-O-C2H5 + H2O
простой эфир
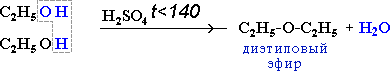
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|