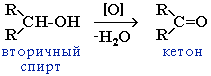- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция по теме: «Кислородсодержащие органические соединения Спирты. Химические свойства предельных одноатомных спиртов».
Лекция по теме: «Кислородсодержащие органические соединения Спирты. Химические свойства предельных одноатомных спиртов».
Содержание темы: реакции с участием водорода, входящего в состав гидроксильной группы спиртов: взаимодействие со щелочным металлом – образование алкоголята; взаимодействие спиртов со спиртами. Основные способы получения спиртов: гидратация алкенов, взаимодействие галогенопроизводных углеводородов со щелочью;
восстановление альдегидов.
Знать:
• понятие о реакциях спиртов с участием водорода, гидроксильной группы – ОН;
основные способы получения спиртов.
Уметь:
подтверждать уравнениями реакций химические свойства спиртов.
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
· С–ОН с отщеплением ОН-группы
· О–Н с отщеплением водорода
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь. Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона (Н+) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О – свойства основания и нуклеофильного реагента.
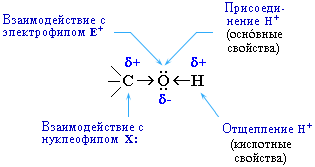 С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления. Таким образом, гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений. Вследствие доступности гидроксильных соединений, в особенности спиртов, каждая из этих реакций является одним из лучших способов получения определенных органических соединений.
1. Кислотно-основные свойства.
RO- + H+ ↔ ROH ↔ R+ + OH-
Кислотные свойства уменьшаются в ряду, а основные возрастают:
С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления. Таким образом, гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений. Вследствие доступности гидроксильных соединений, в особенности спиртов, каждая из этих реакций является одним из лучших способов получения определенных органических соединений.
1. Кислотно-основные свойства.
RO- + H+ ↔ ROH ↔ R+ + OH-
Кислотные свойства уменьшаются в ряду, а основные возрастают:
1.1 Кислотные свойства Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов ("замещаться" на них). Взаимодействие спиртов сактивными щелочными металлами с образованием алкоголятов: 2C2H5OH + 2 Na → 2C2H5ONa + H2 (алкоголят натрия) этилат натрия Атомы натрия легче восстанавливают те атомы водорода, у которых больше положительный частичный заряд ( на себя электронную пару связи R водорода меньше, чем в молекуле воды. В результате атомы натрия труднее восстанавливают атомы водорода в молекулах спиртов, чем в молекулах воды, и реакция идет намного медленнее. метанол С твердыми щелочами и с их растворами спирты не реагируют. *Алкоголяты подвергаются гидролизу, это доказывает,что у воды более сильные кислотные свойства C2H5ONa + H2O ↔ C2H5OH + NaOH
2.2.Основные свойства Спирты взаимодействуют галогенводородными кислотами: C2H5OH + HBr H2SO4(кон)↔ C2H5Br+ H2O бромэтан * Лёгкость протекания реакции зависит от природы галогенводорода и спирта – увеличение реакционной способности происходит в следующих рядах:
2. Окисление 2.1.В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений: Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
При окислении вторичных спиртов образуются кетоны.
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|
 +). И в молекулах воды, и в молекулах спиртов этот заряд образуется за счет смещения в сторону атома кислорода, обладающего большой электроотрицательностью, электронных облаков (электронный пар) ковалентных связей. Молекулу спирта можно рассматривать как молекулу воды, в которой один из атомов водорода замещен углеводородным радикалом. А такой радикал, богатый электронными парами, легче, чем атом водорода, позволяет атому кислорода оттягивать
+). И в молекулах воды, и в молекулах спиртов этот заряд образуется за счет смещения в сторону атома кислорода, обладающего большой электроотрицательностью, электронных облаков (электронный пар) ковалентных связей. Молекулу спирта можно рассматривать как молекулу воды, в которой один из атомов водорода замещен углеводородным радикалом. А такой радикал, богатый электронными парами, легче, чем атом водорода, позволяет атому кислорода оттягивать О. Атом кислорода как бы "насыщается", и за счет этого связь O—H оказывается менее поляризованной, чем в молекуле воды (
О. Атом кислорода как бы "насыщается", и за счет этого связь O—H оказывается менее поляризованной, чем в молекуле воды (