
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Водородная связь.
Водородная связь.
Химическую связь между атомами водорода одной молекулы и атомами электроотрицательных элементов (фтором, кислородом, азотом) другой молекулы называют водородной. Например:
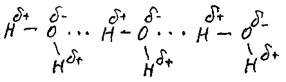 Водородная связь ― это связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы(чаще всего кислородом, азотом, фтором).Водородные связи могут возникать и между разными участками внутри одной молекулы, например в макромолекулах белков и нуклеиновых кислот. Водородная связь имеет частично электростатический характер.
Водородная связь ― это связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы(чаще всего кислородом, азотом, фтором).Водородные связи могут возникать и между разными участками внутри одной молекулы, например в макромолекулах белков и нуклеиновых кислот. Водородная связь имеет частично электростатический характер.
Именно наличие водородных связей обусловливает существование молекулярных ассоциаций (Н2О)3 и (Н2О)4, вторичную структуру (спираль) белков, комплементарность нуклеотидов в нуклеиновых кислотах. Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной. Эта ковалентная связь представлена во всех веществах, образованных несколькими разными неметаллами ― в воде, органических веществах, кислотных оксидах, кислотах и кислотных остатках: H2O, C2H5OH, CO2, SO3, H2SO4, SO42― и так далее.Полярность связи тем больше, чем больше разность электроотрицательностей атомов. Электроотрицательность- это способность атома притягивать электро
ны и общие электронные пары от других атомов. Самый электроотрицатель-
ный элемент - фтор, самый электроположительный – цезий.. Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из атомов, и оба атома превращаются в ионы. Химическая связь между ионами, осуществляется за счет электростатического притяжения. Этот вид связи представлен в тех веществах, которые состоят из атомов типичных металлов и типичных неметаллов – основных оксидах, основаниях, солях: MgO, NaOH, NaCl и других.Ковалентная связь ― осуществляется за счет электронной пары, принадлежащей обоим атомам.Различают обменный и донорно-акцепторный механизм образования ковалентной связи. 1.Обменныймеханизм.
Каждый атом дает по одному неспаренному электрону в общую электронную пару: H• + •H H : H
2. Донорно-акцепторный механизм.
(акцептор) предоставляет для этой пары свободную орбиталь:
Два атома могут обобществлять несколько пар электронов. В этом случае говорят о кратных связях: или О = ОЕсли электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной. Такая связь осуществляется в молекулах и кристаллах простых веществ неметаллов:H2, O2, P4, S8, алмазе, графите, красном фосфор
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|