
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Для алкенов характерна изомерия
КОНСПЕКТ УРОКА
Тема сегодняшнего урока: «Алкены. Этилен».
При дегидрировании этана образуется этилен – родоначальник гомологического ряда алкенов. При потере двух атомов водорода происходит образование не одинарной, а ДВОЙНОЙ связи между атомами С:
500°; Ni
СН3—СН3 — СН2=СН2 + Н2.
Этан этилен
(!) Алкены — это непредельные углеводороды, содержащие одну двойную связь (С= С).
(!) Общая формула: Cn H2n
(!) Гомологический ряд:
С2Н4, или СН2=СН2 этен
С3Н6, или СН2=СН—СН3, пропен
С4Н8, или СН2=СН—СН2 —СН3 бутен-1
(!)Физические свойства алкенов:
С2 – С4 С5 – С17 С18 – С…
↑(Этилен, Н(H2O),З) Ж Т
Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
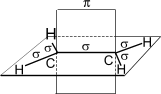
Электронное и пространственное строение этилена:
| Для этилена характерна sp2 – гибридизация (форма молекулы плоский треугольник). Угол = 120° В главной цепи – двойная связь С=С. Цепь нумеруют с того конца, к которому она ближе. |
|
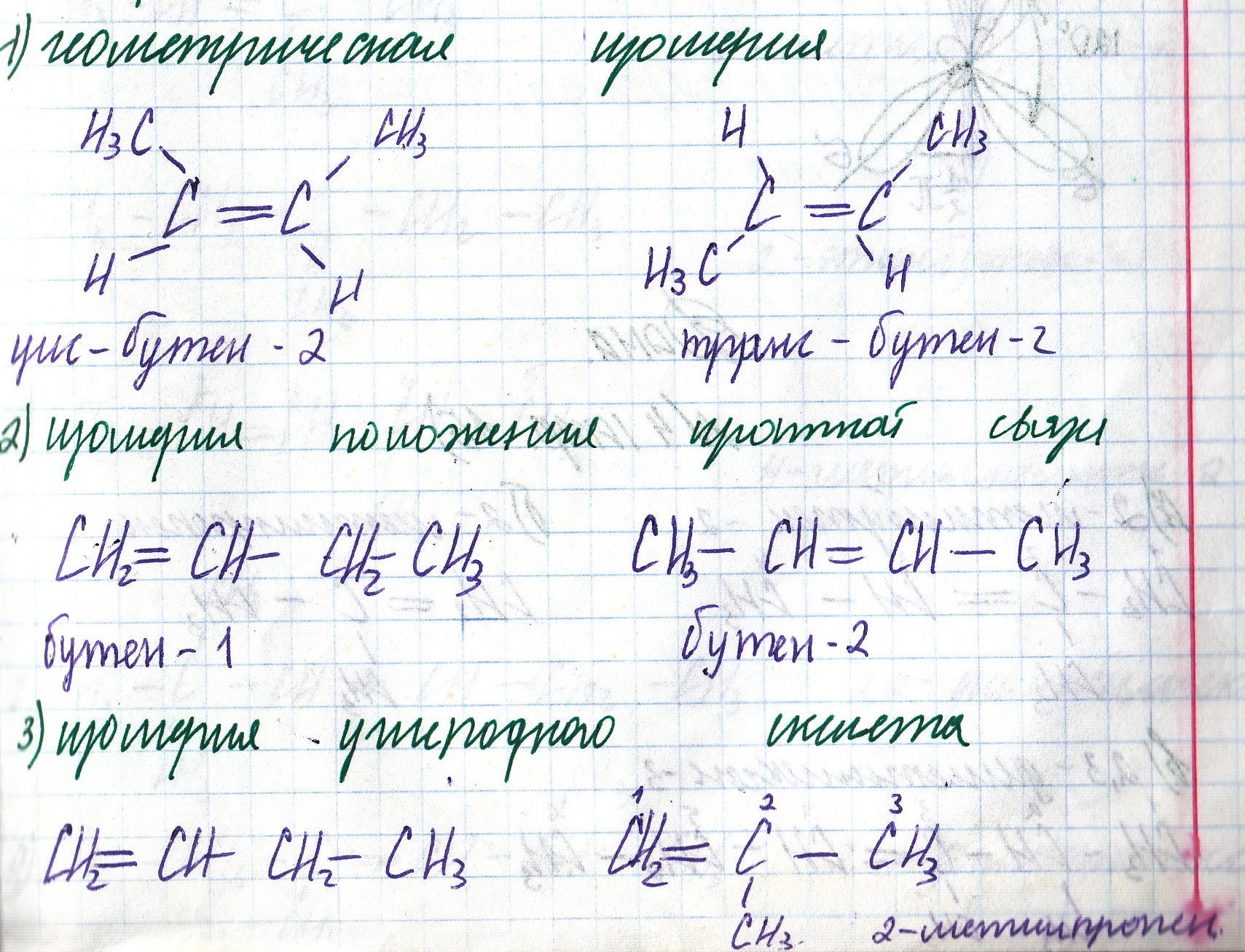
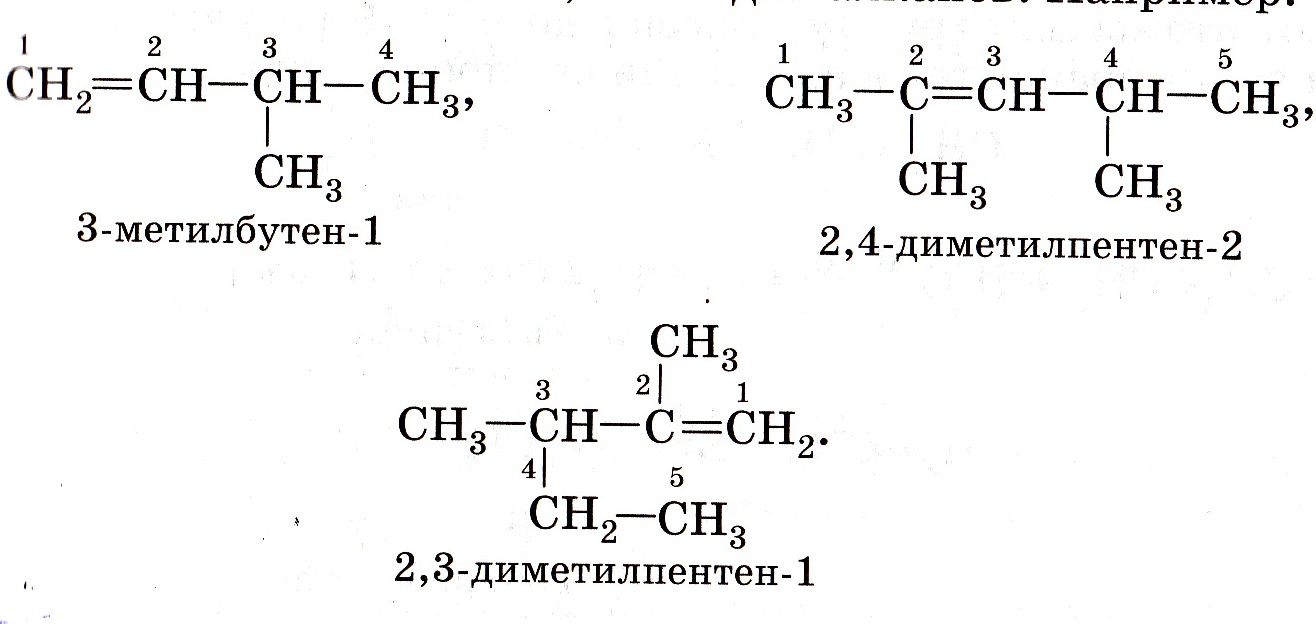
(!)Номенклатура и изомерия:
Для алкенов характерна изомерия
- Геометрическая (пространственная)
- Положения кратной связи
- Углеродного скелета
- Межклассовая (с циклоалканами, цикл содержат)
(!)Применение алкенов (полиэтилен): медицинское оборудование, предметы домашнего обихода, пленка, клейкая лента, трубы, шланги, упаковочная пленка, пакеты, детали. (Этилен):для ускорения созревания плодов, пр-во органических соединений, растворителей, спиртов, уксусной кислоты.
(!)Получение алкенов:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|