
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
АЛКЕНЫ (ОЛЕФИНЫ) Сn Н2n. ХИМ. СВ-ВА АЛКЕНОВ. Р-ЦИИ АЛКЕНОВ . Р-ции А идут с разрывом p-связи. СH2 = СH2 +Br2 →Br-СH2- СH2-Br
АЛКЕНЫ (ОЛЕФИНЫ) Сn Н2n
СН2=СН2 ЭТИЛЕН, ЭТЕН
СН3-СН=СН2 ПРОПИЛЕН, ПРОПЕН
СТРОЕНИЕ
Н Н
σ \ σ / σ атом С в sр2-гибрид.;
С = С валент.угол - 120°;
σ / π \ σ энерг. дв. связи: 620
Н Н кДж/ моль
ИЗОМЕРИЯ
1) структур.: а) С-цепи; б) кратн. связи
2) пространственная: цис-транс
СН3 С2Н5 СН3 Н
\ / \ /
С = С С = С
/ \ / \
Н Н Н С2Н5
цис- транс-
Z,E- номенк-ра
При налич.3х или 4х - различ. замест. применZ,E- номенк-ру:
Z- изомеры - старшиезамест. по однусторону (вместе) от плоск. двойн. связи
E- изомеры - старшиезамест. наход-ся по разн.стороны (напротив) плоск. дв. св.
Старшинство опред-ся:
- порядк. N элемен. в табл. Менделеева;
- в ряду алкилов: третич>вторич>первичн> >метил >Н
ХИМ. СВ-ВА АЛКЕНОВ
π –связь и взаим. влиян. атом. в мол-ле.
Легкость разрыва связи зависит от типаи местоположения связи в алкене.
Энерг. хар-ка связей в мол-ле бутена-1:
СН2 = СН – СН2 – СН3
a b
| Тип связи | С-С (σ) | С-С (π) | С-Н (α) | С-Н (β) | (С-Н) sр2 |
| Энергия | 263 | 326 | 405 | 440 |
Р-ЦИИ АЛКЕНОВ
1) Присоед.: А→ AE ; AR (свет, R• )
2) Окисл-я
3) Полимер-ции
4) Замещ. (S) в аллильн. полож.
І. Р-ции А (присоед.)
Р-ции А идут с разрывом p-связи
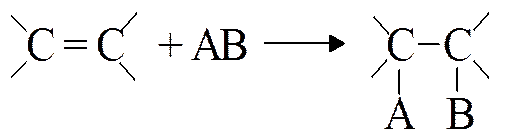
Мах электр. плотн. сосредоточ-на в обл-ти p-связи. Ее атакуют электрофилы (Е+) или радикалы (R•). Поэтому
для алкеновр-ции присоед.: АE и АR.
1. Присоед. галоген. к этилену и симм. алкенам:
 Х = Сl2, Вr2; активность: F2>Cl2> Br2>>I2
Х = Сl2, Вr2; активность: F2>Cl2> Br2>>I2
Бромиров. этиленa (кач. р-ция на кратн.связь)
СH2 = СH2 +Br2 →Br-СH2- СH2-Br
1,2-дибромэтан
Механизм АЕ
I стадия:
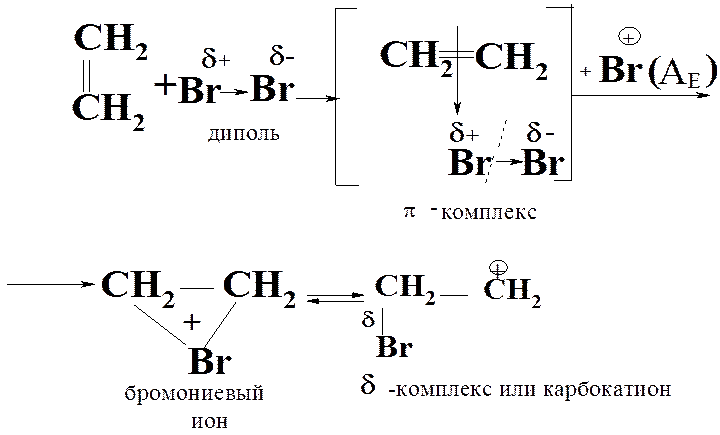
1) образ. диполя: Вrd+® Вrd-
(под влиян. p-эл.);
2) образ. p- компл.: взаимод. электрофил. части диполя с p-элек. (как. дон.-акц. св.)
3) образ. циклич. бромониев. катион. c Br+ (АЕ );
II стадия:
образов. прод-та р-ции:
анион Вr атакует циклич. катион
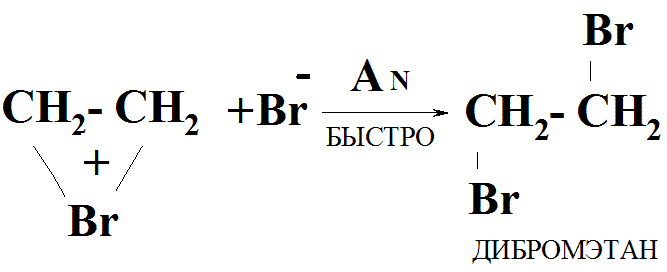
(АN - р-ция ионная, протек. быстро;
по сравнению с ней АЕ -медленно ), поэтому
АЕ - лимитирующая (самая медленная) стадия, определяет механизм всего процесса.
2. Присоед. реаг-тов к несимм. алкенам
а) присоед. по прав. Марковникова
Правило Марковникова: при гетеролитичес-ком присоед. к несимм. алкенам водород (или люб. электрофил. част-ца) направл-ся к наиболее гидрогенизированному атому С по месту разрыва кратной связи.
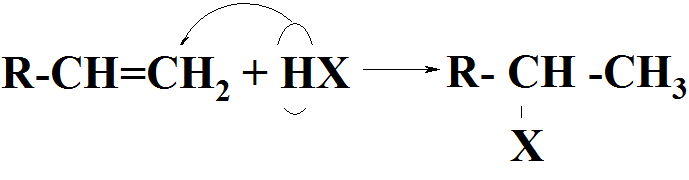
где НХ = НСl, НВr, НI, НОН,
НОSO3H, ROHи т.п.
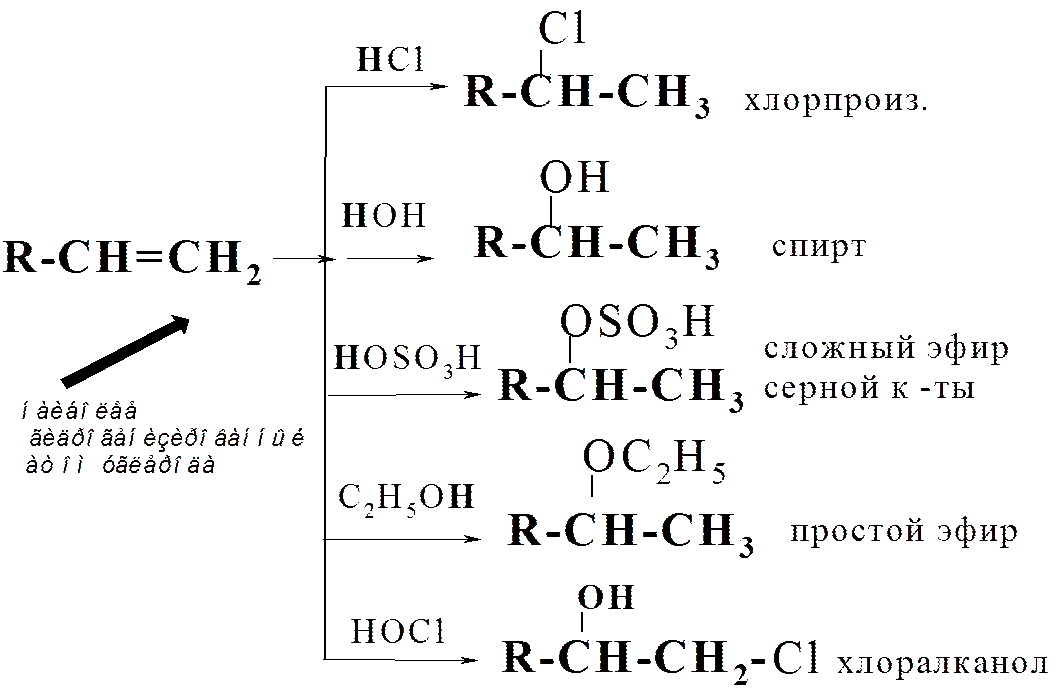
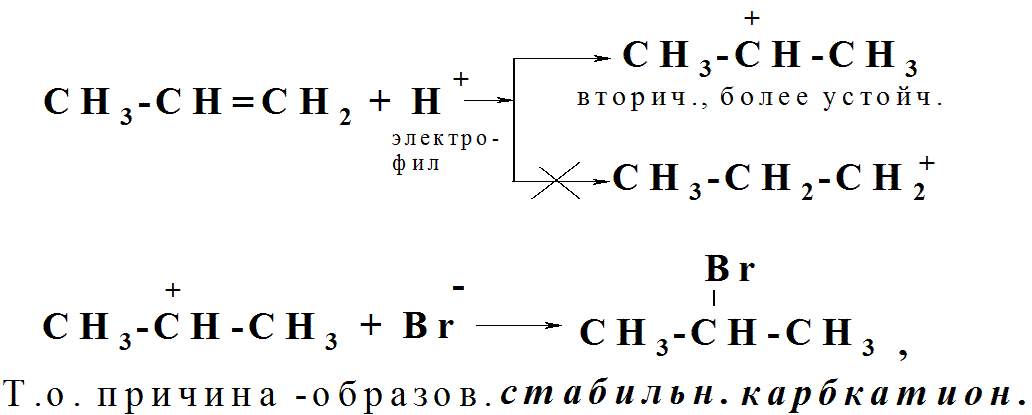
Соврем. трактовка пр. Марковникова:
Br
CH3-CH=CH2 + НBr → CH3-ĆH-CH3
Механизм АЕ
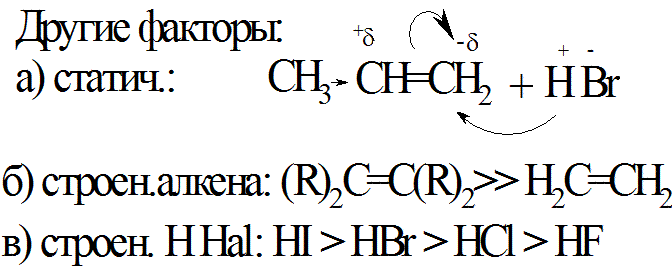
б) присоед. против пр. Марковникова -
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|