
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ряд напряжений металлов
8.2. Ряд напряжений металлов
Электродный потенциал является постоянной величиной при данной температуре, если пластинка металла погружена в раствор его соли с концентрацией (активностью) ионов металла, равной единице 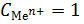 моль/л. Такой потенциал называется стандартным электродным потенциалом.
моль/л. Такой потенциал называется стандартным электродным потенциалом.
Стандартные электродные потенциалы могут служить для сравнения химической активности металлов. Однако, непосредственно измерить величину потенциала отдельного электрода нельзя. Ее измеряют относительно стандартного водородного электрода.
Он представляет собой платиновую пластинку, покрытую рыхлым слоем электролитически осажденной платины. Пластинка погружена в раствор серной кислоты с концентрацией ионов водорода равной 1 моль/л. Через раствор пропускается газообразный водород под давлением в 1 атм, который адсорбируется платиной (2Н+| Н2, Pt) (рис. 3).
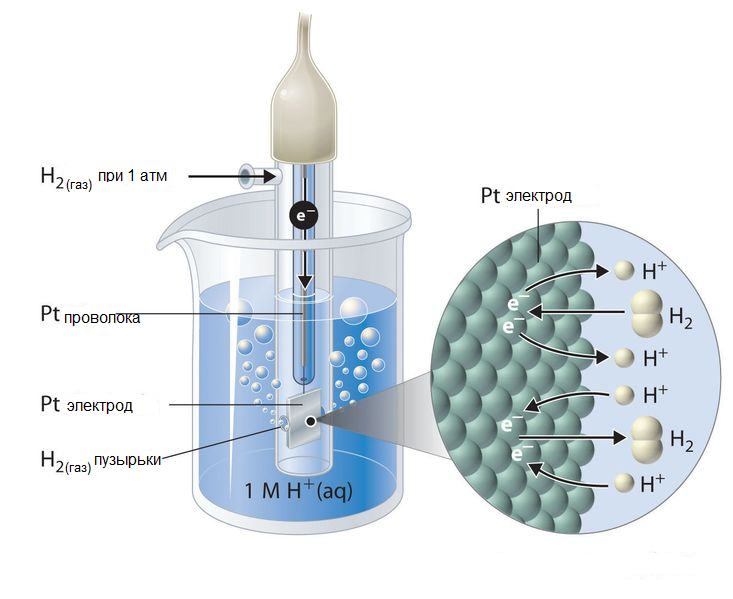
Рис. 3. Схема строения водородного электрода
На электроде протекает обратимый процесс Н20 – 2ē ↔ 2Н+.
Величину потенциала такого электрода условно принимают за ноль при всех значениях температур 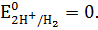
Нужно отметить, что равновесный потенциал водородного электрода зависит от концентрации ионов водорода:

| (6) |
Учитывая, что n = 1,  , получим
, получим

| (7) |
Располагая металлы в порядке возрастания величины их стандартных электродных потенциалов, получают электрохимический ряд напряжений металлов.

В этом ряду знак «минус» электродного потенциала указывает на то, что данный металл окисляется легче, чем водород, а ионы металла восстанавливаются труднее, чем ионы водорода.
Чем меньше величина потенциала, т.е. чем электроотрицательней металл, тем выше восстановительная способность его ионов, тем он активнее.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|