
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция 8. Электрохимические процессы
Лекция 8. Электрохимические процессы
Электрохимия – область химии, изучающая процессы взаимного превращения электрической и химической форм энергии.
Электрохимические процессы протекают на границе раздела фаз «электрод – электролит»: в гальваническом элементе; при электролизе; в случае электрохимической коррозии металлов.
Эти процессы относятся к окислительно-восстановительным реакциям, но отличаются тем, что процессы окисления и восстановления пространственно разделены, а электроны направленно перемещаются по проводнику.
Замкнутая часть пространства, в которой может протекать по меньшей мере одна электрохимическая окислительная и одна электрохимическая восстановительная реакции, называется электрохимической системой.
Электрохимическая система, в которой энергия самопроизвольной химической окислительно-восстановительной реакции превращается в электрическую, называется гальваническим элементом.
8.1. Электродные потенциалы
Электрод – это система, состоящая из двух контактирующих фаз: материала с электронной проводимостью (чаще металл) и ионного проводника (раствор или расплав электролита).
Механизм действия гальванического элемента связан с особенностями кристаллической структуры металлов. В узлах кристаллической решетки металлов находятся катионы. Внутри металла устанавливается подвижное равновесие:
| Ме ↔ Меn+ + nē | (1) |
При погружении активного металла в электролит его ионы под действием полярных молекул воды отрываются от твердой поверхности и в виде гидратированных ионов переходят в раствор (рис. 1):
| Меn+ + mH2O ↔ Me(H2O)n+m(р-р) | (2) |
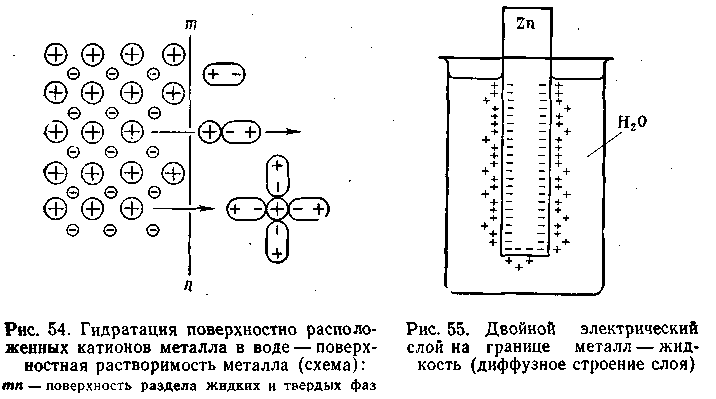
Рис. 1. Схема взаимодействия ионов поверхностного слоя металла с молекулами воды
В одном случае раствор заряжается положительно, а на металле появляется избыток свободных электронов, придающих металлу отрицательный заряд. Катионы, перешедшие в раствор, притягиваются отрицательно заряженным металлом и располагаются вблизи его поверхности (рис. 2а). В результате образуются два слоя с противоположными зарядами, так называемый двойной электрический слой с определенной разностью потенциалов, которую принято называть электродным потенциалом металла.
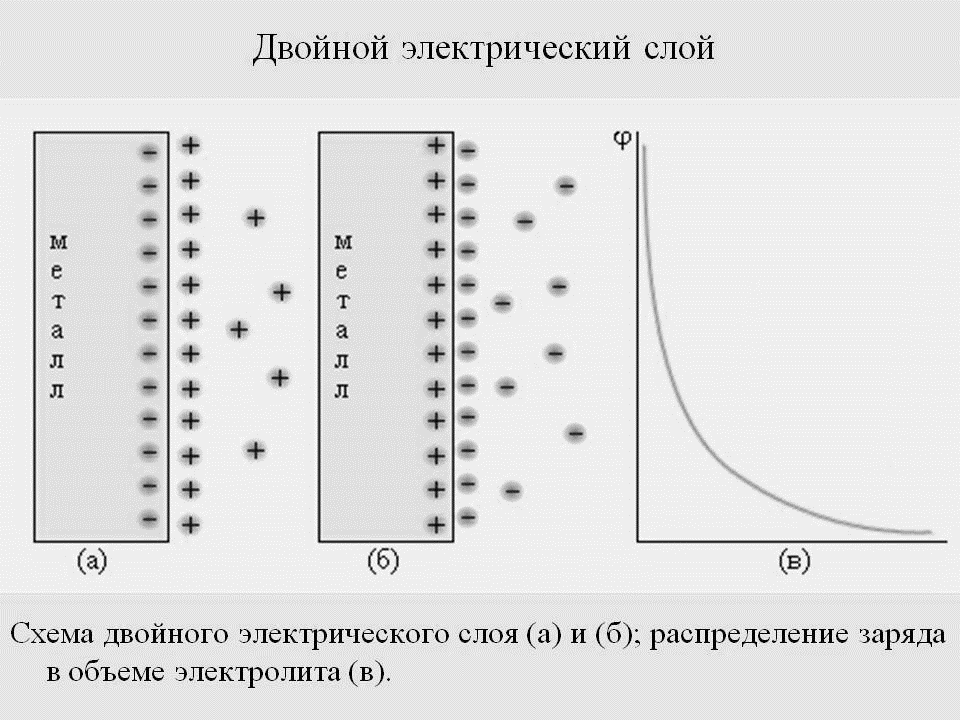
Рис. 2. Схема строения двойного электрического слоя: а – активного металла;
б – малоактивного металла
По мере перехода катионов металла в раствор отрицательный заряд металла растет. Растет и скачок потенциала на границе раздела фаз «металл – раствор электролита». Накопление ионов металла в растворе начинает тормозить дальнейшее растворение металла. Устанавливается динамическое равновесие:
| Ме + mH2O ↔ Me(H2O)n+m + nē | (3) |
Внесение в раствор одноименных ионов смещает это равновесие влево, а удаление избыточных электронов – вправо. Последнее и осуществляется в гальванических элементах.
Для малоактивных металлов равновесная концентрация ионов невелика. Если такой металл погрузить в раствор его соли, где концентрация ионов явно больше равновесной, то часть катионов потеряет гидратную оболочку и перейдет из раствора в кристаллическую решетку металла, зарядив его положительно. Раствор приобретает при этом отрицательный заряд (рис. 2б).
Разность потенциалов, которая возникает на границе раздела фаз «металл – раствор» при наступлении равновесия, называют равновесным электродным потенциалом металла ( 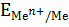 ). Знак потенциалу приписывают тот, который возникает на металле в двойном электрическом слое.
). Знак потенциалу приписывают тот, который возникает на металле в двойном электрическом слое.
Равновесный электродный потенциал зависит от природы металла, концентрации (активности) его ионов в растворе и температуры. Эта зависимость выражается уравнением Нернста.
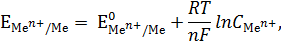
| (4) |
где: 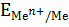 – равновесный электродный потенциал металла, В;
– равновесный электродный потенциал металла, В; 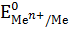 – стандартный электродный потенциал при концентрации (активности) ионов металла в растворе равной единице, В; R – универсальная газовая постоянная, равная 8,31 Дж/К·моль; Т – температура, К (принимается равное 298 К); n – валентность металла (число электронов, участвующих в процессе); F – число Фарадея, равное 96500 Кл/моль.
– стандартный электродный потенциал при концентрации (активности) ионов металла в растворе равной единице, В; R – универсальная газовая постоянная, равная 8,31 Дж/К·моль; Т – температура, К (принимается равное 298 К); n – валентность металла (число электронов, участвующих в процессе); F – число Фарадея, равное 96500 Кл/моль.
С учетом численных значений постоянных величин, температуры. Заменив натуральный логарифм десятичным, получим:
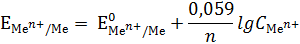
| (5) |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|