
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Основание + оксид → СМ. ТЕМУ «ОКСИДЫ»
Раздел «Атомы и связи»
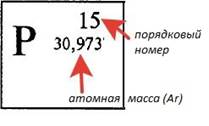
СМОТРИМ В ТАБЛИЦУ МЕНДЕЛЕЕВА
Пример: атом фосфора
Атом состоит из ядра и электронов (е)
Ядро состоит из протонов (р) и нейтронов (n)
Кол-во (р) = кол-ву (е) = порядковому номеру
Кол-во (n) = атомная масса (Ar) – порядковый номер.
Для фосфора:
р=15
п=31-15=16
е=15
Электроны находятся на энергетических уровнях
Кол-во уровней = номеру периода!
У фосфора 3 уровня (потому что стоит в 3 периоде)
На 1 уровне максимально 2е
На 2 уровне максимально 8е
На 3 уровне максимально 18е
На 4 уровне максимально 32е
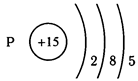
Кол-во электронов на внешнем уровне = номеру группы!
У фосфора их 5, он стоит в 5 группе.
(помним, что в 4 периоде идёт нарушение.
У калия 1 внешний электрон, от Са до Zn два
электрона на внешнем уровне)
 Молекулярная масса (Mr) = сумме атомных масс (Ar).
Пример: молекула H3PO4
Mr (H3PO4) = Ar(H)∙3 + Ar(P)∙1 + Ar(O)∙4 =
= 1∙3 + 31∙1 + 16∙4 = 98
Массовая доля элемента в молекуле (ω) – это сколько процентов приходится на тот или иной элемент.
Пример: молекула H3PO4
Массовая доля кислорода в этой молекуле:
ω (o) =
Молекулярная масса (Mr) = сумме атомных масс (Ar).
Пример: молекула H3PO4
Mr (H3PO4) = Ar(H)∙3 + Ar(P)∙1 + Ar(O)∙4 =
= 1∙3 + 31∙1 + 16∙4 = 98
Массовая доля элемента в молекуле (ω) – это сколько процентов приходится на тот или иной элемент.
Пример: молекула H3PO4
Массовая доля кислорода в этой молекуле:
ω (o) = 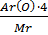 * 100% =
* 100% = 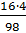 * 100% = 65 %
Связи в молекулах
1. Ионная (между металлом и неметаллом)
Примеры: NaCl, K2S
2. Ковалентная НЕполярная (между двумя одинаковыми неметаллами)
Примеры: N2, Cl2
3. Ковалентная полярная (между двумя разными неметаллами)
Примеры: HCl, SO3
4. Металлическая (между металлами)
Примеры: Fe, Cu
* 100% = 65 %
Связи в молекулах
1. Ионная (между металлом и неметаллом)
Примеры: NaCl, K2S
2. Ковалентная НЕполярная (между двумя одинаковыми неметаллами)
Примеры: N2, Cl2
3. Ковалентная полярная (между двумя разными неметаллами)
Примеры: HCl, SO3
4. Металлическая (между металлами)
Примеры: Fe, Cu
Степени окисления
СМОТРИМ В ТАБЛИЦУ МЕНДЕЛЕЕВА
Для металлов: всегда положительная, равно номеру группы!
Например: Al +3, потому что он стоит в 3 группе!
Есть металлы с переменной степенью окисления:
железо (Fe) бывает +2 и +3
медь (Cu) бывает +1 и +2
Для неметаллов: бывает и положительная, и отрицательная.
Знать: у кислорода (О) чаще всего -2
у водорода (Н) чаще всего +1
Как расставлять индексы в формулах бинарных соединений? (если всего два элемента)
Например: нужно написать оксид натрия.
Пишу NaO.
Рассуждаю: натрий — это металл, он стоит в 1 группе таблицы Менд., значит у него степень окисления +1, у кислорода будет -2.

 Оксиды
Оксиды
Несолеобразующие Солеобразующие

 SiO
SiO
CO Основные Амфотерные Кислотные
N2O (Ме +1, +2) (Ме +3, +4) (Ме +5, +6, +7,
NO и все неМе)
Искл:
BeO, ZnO,
SnO, PbO
Примеры:
Na2O– это основный оксид, потому что Na это металл, который имеет степень окисления +1, потому что стоит в 1 группе таблицы Менделеева.
Al2O3 – это амфотерный оксид, потому что Al это металл, который имеет степень окисления +3, потому что стоит в 3 группе таблицы Менделеева.
N2O3 – это кислотный оксид, потому что N это неметалл и в списке несолеобразующих этого оксида нет.
Химические свойства кислотных оксидов:
1. Кисл.Оксид + вода → кислота

 SO3 + H2O → H2SO4
SO3 + H2O → H2SO4
2. Кисл.Оксид + осн.оксид → соль
SO3 + Na2O → Na2SO4
3. Кисл.Оксид + Кисл.Оксид НЕ РЕАГИРУЮТ
4. Кисл.Оксид + основание → соль + вода
SO3 + 2NaOH → Na2SO4 + H2O
5. Кисл.Оксид + кислота НЕ РЕАГИРУЮТ
6. Кисл.Оксид + соль НЕ РЕАГИРУЮТ
7. Кисл.Оксид + кислород → новый оксид
Реакция возможна только если металл в оксиде находится не в максимальной степени окисления
2SO2 + O2 → 2SO3 (сера была +4, а стала +6)
SO3+ O2 НЕ РЕАГИРУЮТ
(сера +6, выше не бывает)

 группы ОН-
Растворимые Нерастворимые
(щелочи) (СМОТРИ ТАБЛИЦУ
NaOH РАСТВОРИМОСТИ,
KOH ТАМ БУДЕТ СТОЯТЬ «Н»)
LiOH
Взаимодействие щелочей с индикаторами:
Лакмус (фиолет.) – становится СИНИМ
Метилоранжевый (оранж.) - становится ЖЁЛТЫМ
Фенолфталеин (бесцв.) - становится РОЗОВЫМ
группы ОН-
Растворимые Нерастворимые
(щелочи) (СМОТРИ ТАБЛИЦУ
NaOH РАСТВОРИМОСТИ,
KOH ТАМ БУДЕТ СТОЯТЬ «Н»)
LiOH
Взаимодействие щелочей с индикаторами:
Лакмус (фиолет.) – становится СИНИМ
Метилоранжевый (оранж.) - становится ЖЁЛТЫМ
Фенолфталеин (бесцв.) - становится РОЗОВЫМ
Химические свойства оснований:
1. Основание + вода НЕ РЕАГИРУЮТ
2.Основание + оксид → СМ. ТЕМУ «ОКСИДЫ»
3. Основание + кислота → соль + вода
Сa(OH)2 + 2HNO3 → Сa(NO3)2 + 2H2O