
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Оборудование и реактивы.. Выполнение работы.
Оборудование и реактивы.
1. Секундомер;
2. Термостат;
3. Три пробирки;
4. Дистиллированная вода;
5. 1 н. раствор тиосульфата натрия Na2S2O3;
6. 2 н. раствор серной кислоты H2SO4.
Опыт 1. Взаимодействие тиосульфата натрия с серной кислотой.Реакция тиосульфата натрия с серной кислотой протекает по уравнению:
Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O
Признаком реакции является появление слабой опалесценции и дальнейшее помутнение раствора от выпавшей свободной серы.
Выполнение работы.
В трех пробирках приготовлены растворыNa2S2O3 с разной концентрацией (табл. 1): в первой пробирке – 4 капли 2 н. раствора Na2S2O3 и 8 капель H2O; во второй – 8 капель 2 н. раствора Na2S2O3 и 4 капли H2O; в третьей – 12 капель 2 н. раствора Na2S2O3. Таким образом, концентрация Na2S2O3 (в моль) будет: в пробирке № 1 – С ;в пробирке № 2 – 2С, в пробирке № 3 – 3С.
Включите секундомер. В пробирку № 1 добавьте одну каплю 2 н. раствора серной кислоты. По секундомеру измерьте время от момента добавления кислоты до появления в растворе заметной опалесценции. Время в секундах запишите в таблицу. Рассчитайте относительную скорость реакции.
Опыт повторить с пробирками № 2 и № 3.
Таблица 1.
| № пробирки | Число капель 1 н. раствора Na2S2O3 | Число капель H2O | Число капель 2 н. раствора H2SO4 | Общий объем раствора (число капель) | Относительная концентрация раствора Na2S2O3 | Время течения реакции (t, с) | Относительная скорость реакции (1/ t) |
| С | |||||||
| 2С | |||||||
| - | 3С |
Данные опыта занесите в таблицу. Начертите график зависимости скорости реакции от концентрации реагирующих веществ. На оси абсцисс отложите в определенном масштабе относительные концентрации тиосульфата натрия, на оси ординат – соответствующие им скорости.
Сделайте вывод о зависимости скорости химической реакции от концентрации реагирующих веществ.
Опыт 2. Влияние температуры на скорость реакции в гомогенной системе.
Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O
В двух пробирках (№ 2 и № 3) приготовлены растворы Na2S2O3 с одинаковой концентрацией: 4 капли 2 н. раствора Na2S2O3 и 8 капель H2O.
Пробирка № 2 помещена в термостат с температурой на 100С выше комнатной, а пробирка № 3 – в термостат с температурой на 200С выше комнатной.
Включите секундомер. В пробирку № 2 добавьте 1 каплю 2 н. раствора H2SO4. По секундомеру отметьте время от момента добавления кислоты до появления заметной опалесценции, как в опыте 1. Повторите опыт для пробирки № 3.
Результаты опыта занесите в таблицу 2 (экспериментальные данные для комнатной температуры (21 0С) возьмите из опыта 1).
Таблица 2.
| № пробирки | Температура, 0С | Время течения реакции (t, с) | Относительная скорость (1/ t) |
Начертите график зависимости скорости реакции от температуры. На оси абсцисс отложите в определенном масштабе значения температур, на оси ординат – соответствующие им скорости.
Рассчитайте значение температурного коэффициента, исходя из опытных данных:
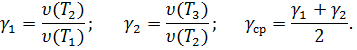
Сделайте вывод о зависимости скорости химической реакции от температуры.
Форма отчета.
Отчет по лабораторной работе должен содержать:
1. Название работы и описание цели ее выполнения.
2. Заполненные таблицы 1 и 2.
3. Графики зависимостей скорости химической реакции от концентрации реагирующих веществ и температуры.
4. Расчеты значения температурного коэффициента.
5. Выводы.
6. Контрольное задание.
Контрольное задание.
Напишите выражение скорости реакций:
а) N2 + O2 = 2NO;
б) CO2 + C = 2CO;
в) FeO + H2 = Fe + H2O.
Как изменится скорость реакции а) при увеличении концентрации исходных веществ в два раза?
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|