
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная работа «Скорость химических реакций»
Лабораторная работа «Скорость химических реакций»
Цель работы:
Изучить влияние концентрации реагирующих веществ и температуры на скорость химических реакций.
Краткие теоретические положения.
Химическая кинетика – раздел химии, изучающий скорости протекания химических реакций и их механизмы.
Скорость химических реакций определяется числом соударений (элементарных актов реакции), приводящих к химическому превращению в единице объема в единицу времени.
Под механизмом реакциипонимают последовательность протекания промежуточных стадий реакции, в результате которой происходит образование конечных веществ.
Мерой скорости химической реакции называется изменение концентрации (или количества вещества) в единицу времени.
Скорость химической реакции – это изменение концентрации реагирующих веществ в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций) раздела фаз.
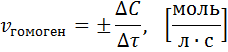
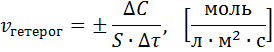
Знак минус (-) для исходных веществ (концентрации исходных веществ со временем уменьшаются), а концентрации продуктов увеличиваются. Скорость же реакции всегда считается положительной величиной.
Факторы, влияющие на скорость химической реакции: природа реагирующих веществ; концентрация реагирующих веществ; температура; наличие катализатора; величина поверхности раздела (для гетерогенных реакций); прочие энергетические воздействия (световое, радиационное облучение и др.).
Зависимость скорости химической реакции от концентрацииреагирующих веществ выражается законом действия масс (К. Гульдберг, П. Вааге, 1867 г.):
Скорость химической реакции при постоянной температуре прямо пропорциональна произведению мольных концентраций реагирующих веществ, возведенных в определенные степени.
Для гомогенной реакции АВ + С = А + ВС:
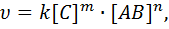
где [С], [АВ] – мольные концентрации реагентов, (моль/л);
k – константа скорости реакции, равная скорости реакции при концентрациях реагирующих веществ, равных 1 моль/л;
m и n – показатели степеней.
Зависимость скорости химической реакции от температуры выражается правилом Вант-Гоффа: При повышении температуры на каждые десять градусов, скорость реакции увеличивается примерно в 2 – 4 раза:
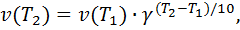
где 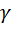 – температурный коэффициент скорости реакции, принимающий значения от 2 до 4.
– температурный коэффициент скорости реакции, принимающий значения от 2 до 4.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|