
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Алгоритм 6.3. Решение расчетных задач по теме «Спирты».
Алгоритм 6.3. Решение расчетных задач по теме «Спирты».
Задача 1. Определить массу альдегида, образовавшегося при окислении этанола (выход 75% от теоретического), если известно, что при взаимодействии такого же количества спирта с металлическим натрием выделилось 5,6 л (н.у.) водорода.
Решение
1. Записать условие задачи.
Дано:
V(H2) = 5,6 л,
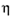 (СН3СОН) = 75%.
(СН3СОН) = 75%.
Найти:
m(СН3СОН).
2. Написать уравнение реакции спирта с натрием и найти количество вещества спирта 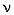 (C2H5OH):
(C2H5OH):
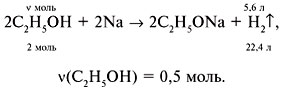
3. Написать уравнение реакции окисления этанола и найти теоретическую массу альдегида mтеор:
mтеор = 22 г.
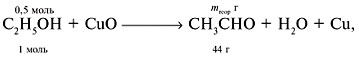
4. Найти практическую массу альдегида:
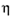 = mпракт/mтеор,
= mпракт/mтеор,
mпракт(СН3СНО) = 0,75•22 = 16,5 г.
Ответ: m(СН3СНО) = 16,5 г.
Задача 2. Смесь этилового и пропилового спиртов массой 16,6 г обработали избытком натрия, при этом выделилось 3,36 л (н.у.) водорода. Определить массовые доли спиртов в смеси.
Решение
1. Записать условие задачи.
Дано:
смесь С2Н5ОН и С3Н7ОН,
m(смеси) = 16,6 г,
V(Н2)=3,36 л.
Найти:
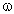 (С2Н5ОН),
(С2Н5ОН),
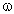 (С3Н7ОН).
(С3Н7ОН).
2. Ввести обозначения:
m(С2Н5ОН) = х г,
m(C3H7OH) = y г.
Составить уравнения реакций:
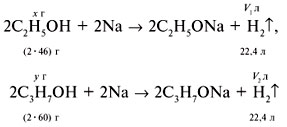
и рассчитать объемы водорода V1 и V2:
V1 = 22,4х/(2•46),
V2 = 22,4y/(2•60).
3. Составить систему уравнений и решить ее:
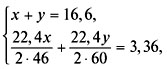
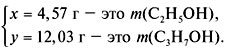
4. Найти массовые доли спиртов в смеси:
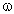 (С2Н5ОН) = 4,57/16,6 = 0,275, или 27,5%,
(С2Н5ОН) = 4,57/16,6 = 0,275, или 27,5%,
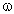 (С3Н7ОН) = 72,5%.
(С3Н7ОН) = 72,5%.
Ответ: 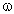 (С2Н5ОН) = 27,5%,
(С2Н5ОН) = 27,5%, 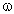 (С3Н7ОН) = 72,5%.
(С3Н7ОН) = 72,5%.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|