
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Суть концепции.. Условия устойчивой гибридизации.. Полезные советы в отношении гибридных представлений.
3. Суть концепции.
Атомные орбитали могут геометрически видоизменяться и смешиваться друг с другом таким образом, чтобы обеспечить наибольшее перекрывание с орбиталями других атомов, и, следовательно, наибольший выигрыш энергии.
Это достигается в том случае, если вместо орбиталей, имеющих разные форму и энергию, появляются одинаковые по форме, энергии гибридные орбитали, представляющие собой линейные комбинации исходных АО.
(Наибольшее перекрывание гибридных орбиталей (по сравнению с АО) обусловлено тем, что они более вытянуты в пространстве).
4. Условия устойчивой гибридизации.
1) В гибридизации могут участвовать орбитали с близкими значениями энергии (с одинаковыми главными квантовыми числами)
Например, 1s-атомные орбитали не участвуют в гибридизации 2s- и 3s-атомных орбиталей.
В результате гибридизации энергии атомных орбиталей с разными значениями орбитального квантового числа l выравниваются , становятся одинаковыми.
2) Гибридная орбиталь должна более полно перекрываться с орбиталями другого атома при образовании связей.
3) Гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга. В этом случае энергия их отталкивания (и, следовательно, энергия всей системы) минимальна.
5. Полезные советы в отношении гибридных представлений.
1. Гибридные представления можно смело использовать в отношении атомов элементов второго периода, с некоторой опаской: в отношении атомов элементов третьего периода. Для атомов элементов 4, 5, 6, 7 периодов гибридные представления не следует применять.
Почему?
Цель гибридизации: выровнять орбитали по форме и энергии, тем самым получить выигрыш в энергии. Чем ниже мы уходим по периоду, тем разница между гибридной и негибридной орбиталью меньше. Где-то, начиная с четвёртого периода, уже негибридная орбиталь не хуже, чем гибридная. А зачем тогда изобретать велосипед, если выигрыша нет?
2. В гибридную комбинацию орбиталей атома следует включать свободные (неподелённые) электронные пары.
Очень часто органики непонятно по каким причинам приклеивают гибридные комбинации концевым атомам. Я хочу напомнить слова Полинга (отца, основателя гибридизации), который писал о том, что гибридные представления разумны и годятся только для атома, связанного с несколькими атомами. А концевой атом связан всегда с одним! Ему не нужно никакой гибридизации. В принципе, ему можно приписать гибридизацию, но нужно помнить, что, чтобы сделать гибридную комбинацию, нужно потратиться! А зачем тратиться, если у меня есть орбиталь, с которой я могу образовать связь.
Поэтому по-хорошему гибридные комбинации для концевых атомов не нужны! Я ссылаюсь на авторитет Полинга.
3. Примерный способ определения типа гибридизации:
n – число партнёров по химической связи атома, для которого ищут гибридную комбинацию.
m – число свободных пар этого атома.
n + m = 2, 3, 4, 5, 6
sp sp2 sp3 sp3d sp3d2
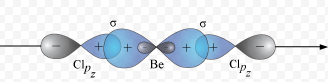
6. sp-гибридизация на примере BeCl2.
BeCl2: n=2
n+m=2 → sp-гибридизация
m=0
Здесь гибридизации подвергнется одна s- и одна p-орбиталь (отсюда sp-гибридизация) атома Be.
Напомню, число гибридных орбиталей равно суммарному числу исходных орбиталей:
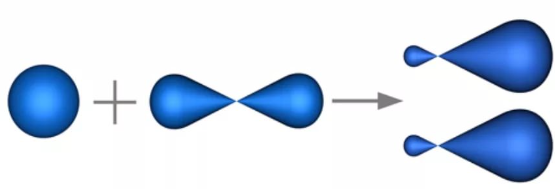
Из двух s- и р-орбиталей формируется две гибридные орбитали (для наглядности показано раздельно).
Два образующихся гибридных sр-электронных облака имеют ассиметрическую форму, которая обеспечивает бОльшее перекрывание с электронными облаками других атомов, чем перекрывание, возникающее с участием чистых негибридных s- и р-облаков. Тем самым гибридизация электронных облаков приводит к выигрышу энергии в результате образования более прочных химических связей. Этот выигрыш в энергии покрывает и затраты энергии на гибридизацию.
Два гибридных облака (sp) в результате взаимного отталкивания располагаются так, что угол между ними составляет 180⁰. В результате такого расположения гибридных облаков молекулы состава АВ2, где А является центральным атомом, имеют линейную конфигурацию, то есть ядра всех взаимодействующих атомов располагаются на одной прямой.
7. sp2- гибридизация.
Это смешение одной s- и двух p-орбиталей. В результате линейной комбинации трёх исходных орбиталей возникают три гибридные sp2-орбитали. Они располагаются в одной плоскости под углом 120⁰ друг к другу.
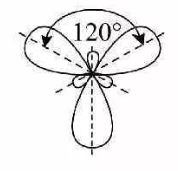
В результате имеем форму плоского треугольника.
8. sp3- гибридизация.
Это смешение одной s и трёх p-орбиталей. Четыре sp3-орбитали располагаются под углом 109⁰28ʹ друг к другу. Они направлены к вершинам тетраэдра, в центре которого находится ядро атома.
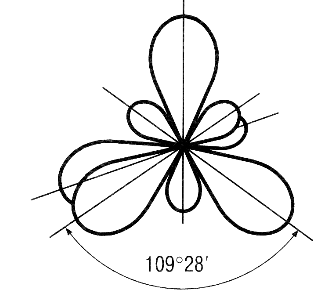
Образование четырёх равноценных химических связей за счёт перекрывания sp3-орбиталей с орбиталями других атомов характерно для атома углерода, что очень важно в органической химии.
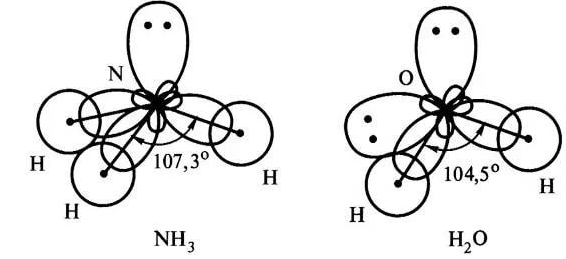
9. Неподелённые электронные пары гибридных орбиталей.
Бывают случаи, когда гибридная орбиталь оказывается занятой несвязывающей электронной парой. Это оказывает влияние на геометрию молекул. Поскольку несвязывающая электронная пара испытывает воздействие ядра только со своего атома, а связывающие пары находятся под действием двух ядер, несвязывающая электронная пара занимает бОльшее пространство.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|