
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Основы аналитической химии. Практическое руководство / Под ред. Ю.А.Золотова, Т.Н.Шеховцовой, К.В.Осколка. 2-е изд. М.: Лаборатория знаний, 2018. 462 с.
Основы аналитической химии. Практическое руководство / Под ред. Ю.А.Золотова, Т.Н.Шеховцовой, К.В.Осколка. 2-е изд. М.: Лаборатория знаний, 2018. 462 с.
Работа 1, с. 197. Стандартизация соляной кислоты по карбонату натрия.
Работа 2, с. 198. Стандартизация раствора гидроксида натрия по соляной кислоте.
Заполните дома первые страницы журнала в соответствии с приведенной ниже формой.
Выполните дома (до практикума!) все требуемые расчеты. При их выполнении обратите внимание на следующие моменты.
- При расчете массы навески Na2CO3 все атомные массы элементов следует брать с точностью не менее 0,01 (а лучше 0,001!) а.е.м. Подумайте: почему?
- А вот при расчете объема конц. HCl вполне допустимо округлять атомные массы до 0,5 ед. Почему здесь так?
(это левая страница разворота журнала А4)
Приготовление первичного стандартного раствора Na2CO3
- Расчет навески для приготовления 200.0 мл 0,1000 М ½ Na2CO3
m = M(1/2 Na2CO3).c.V
M(1/2 Na2CO3) =
m =
- Взятие навески
Масса, г
стаканчик с навеской
стаканчик
навеска
- Расчет концентрации раствора Na2CO3
Приготовление вторичного стандартного раствора HCl
Расчет объема конц. HCl для приготовления 2 л ~0,1 М HCl
HCl конц.: w ~ 35% масс., d ~ 1,17 г/мл.
V(HCl конц.) =
Приготовление вторичного стандартного раствора NaOH
Расчет объема 2 М NaOH для приготовления 2 л ~0,1 M NaOH
V(NaOH 2 M) =
-------------------------------------------------------------------------------
Расчет концентрации HCl в стандартизируемом растворе
c(HCl) = 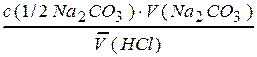 =
=
(это правая страница разворота журнала А4)
06.09.2019
Стандартизация HCl по Na2CO3
½ Na2CO3 + HCl ® ½ H2CO3 + NaCl
Индикатор - метиловый оранжевый (рТ ~4)
Методика
В колбу для титрования поместить:
= 10,00 мл стандартного раствора Na2CO3;
= 20 мл воды;
= 1-2 капли раствора индикатора (метиловый оранжевый).
Титровать стандартизируемым раствором HCl до начала изменения окраски из желтой в желто-розовую (раствор сравнения - "свидетель", щелочной раствор, содержащий индикатор).
Результаты титрования
V(HCl), мл
среднее
| c(HCl) = M |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|