
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Слабые электролиты. Константа диссоциации
рН + рОН = 14
Слабые электролиты. Константа диссоциации
Диссоциация слабой кислоты: CH3COOH Û H+ + CH3COOˉ
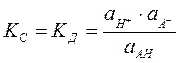 g = 1 (взаимодействие слабое) Þ а = g с = с
g = 1 (взаимодействие слабое) Þ а = g с = с
KД= [Н+]· [CH3COO -] / [CH3COO],
где [Н+]; [CH3COO -] ;[CH3COO] - равновесные концентрации
Связь между KД и α(альфа) степенью диссоциации слабого электролита
KД = a² С0 2 / (1 - a) С0= a² С0 / (1 - a) закон Оствальда
Решение по строгой формуле a= 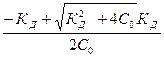
если α<<1 , то 1 - a ≈ 1 KД = α²C0
Расчет a по строгой или приближенной формуле, затем расчет рН
рН=-lg[Н+]=-lg(a·С0 )
Сильные электролиты. Расчет рН
HCl → H + + Cl─
Правило ионной силы
ионы одинаковой зарядности в разбавленных растворах сильных электролитов с одинаковой ионной силой имеют равные коэффициенты активности.
Ионной силой раствора называется полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат их заряда
I=0,5∑Сizi2
Ионная сила раствора I - количественная характеристика межионного взаимодействия
Iр-ра = 0,5×å (сi ××z2i) ÞgН+ (по таблице или формуле) Þ
аН+ = gН+ ×сН+ Þ рН = -lg аН+
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|