
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Электролитическая диссоциация воды. Водородный показатель рН
Растворы электролитов, рН.
Концентрация –содержание растворенного вещества в единице массы или объема раствора или растворителя
молярная концентрация (СМ или М) - число молей растворенного вещества в 1 литре раствора; 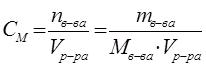 [моль/л]
[моль/л]
нормальная концентрация (СН или Н)- число молей эквивалента растворенного вещества в 1 литре раствора; 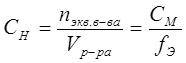 [моль экв/л]
[моль экв/л]
моляльность (Сm ) - число молей растворенного вещества в 1000 г растворителя
титр (г/мл ) - число граммов растворенного вещества в 1 мл раствора 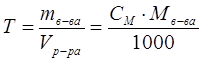 [г/мл, г/см3]
[г/мл, г/см3]
массовая доля - отношение массы растворенного вещества к массе раствора; 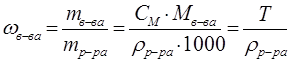 (доли или ´100%)
(доли или ´100%)
r - плотность раствора [г /мл, г/см3]
молярная доля вещества В (χВ) – отношение числа молей данного компонента к сумме молей всех компонентов раствора χВ= nВ /Σ ni
- все виды концентраций взаимосвязаны
- для перехода от массовой концентрации к объемной и наоборотнадо знать ρ
(часто для водных растворов принимают ρр-ра≈1г/мл)
Электролиты – вещества растворы или расплавы которых проводят электрический ток
Электролитическая диссоциация – процесс распада электролита на ионы
под действием молекул растворителя
α (альфа) - степень диссоциации отношение концентрации молекул, распавшихся на ионы (Сдис), к общей концентрации растворенных молекул электролита (СO): α = Сдис/CO
α(альфа) = 1 сильные электролиты, αпочти ни зависит отСO
в водном растворе – это большинство солей, щелочей (основания s-элементов, кроме Be(OH)2 и Mg(OH)2), кислоты НCl, HBr, HI, HNO3, H2SO4, HClO4 и др.
α (альфа) < 1 слабые электролиты, α ↓ с ростом СO (вода, в водном растворе - это органические и ряд неорганических кислот, основания р-, d- и f-элементов, комплексные ионы)
Электролитическая диссоциация воды. Водородный показатель рН
Вода - очень слабый электролит: Н2О Û Н+ + ОН-;
Для описания свойств растворов вместо концентрации используют активность (активную концентрацию - a) a =g·C
где g - коэффициент активности, который показывает степень отклонения какого-либо свойства реального раствора от теоретически рассчитанной величины для идеального раствора, в котором взаимодействия между компонентами отсутствуют.
KД= aH+·аОH‾ / аН2О=1,8 ×10-16 при Т=298 К аН2О = const
ионное произведение воды: KВ= aH+·аОH‾ =10-14
логарифмическая форма ионного произведения Н2О: lgKW= lgaH+ + lgaOH- = -14
-lgaH+ = рН водородный показатель; aH+=10 -РН
-lgaOH- = рОН показатель ионов ОН-; a ОH-=10 -РОН
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|