
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Задания. Одиннадцатый класс
Задания
Одиннадцатый класс
Задача 11-1.
В предлагаемом Вашему вниманию сканворде по горизонтали зашифрованы названия известных органических веществ. В выделенном вертикальном столбце зашифрована фамилия русского химика-органика. Используя подсказки, разгадайте зашифрованные названия и фамилию ученого.

1. строение этого соединения можно описать двумя структурами Кекуле;
2. это сладкое вещество содержится в мёде;
3. раствором этого соединения смачивают ватку перед тем, как делают уколы;
4. получается по реакции Зинина из нитробензола;
5. карболовая кислота;
6. 40 %-ный водный раствор этого вещества известен под названием "формалин";
7. образуется при гидролизе крахмала;
8. этот полимер имеет аббревиатуру ПВХ.
Напишите уравнения реакций (с указанием всех продуктов и реагентов):
а) взаимодействия вещества 1 с нитрующей смесью;
б) окисления вещества 3 перманганатом калия в присутствии серной кислоты;
в) взаимодействия соединения 4 с нитритом натрия в солянокислой среде при 0 °С;
г) бромирования вещества 5 избытком бромной воды;
д) взаимодействия соединения 6 с избытком гидроксида калия при нагревании;
е) реакции водного раствора вещества 7 с аммиачным раствором оксида серебра.
Задача 11-2.
Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и нерастворимы в ней. Хорошо растворяются в органических растворителях, и сами являются хорошими растворителями для многих органических веществ. Бензол и его гомологи широко применяются как химическое сырье для производства лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
1. Напишите общую формулу углеводородов гомологического ряда бензола. Какие Вы знаете гомологи бензола с общей формулой С8Н10? Приведите их структурные формулы и названия.
2. Напишите уравнения реакций их окисления перманганатом калия в серной кислоте при нагревании и назовите образующиеся органические продукты.
Один из изомеров, приведенных Вами в п.1 (назовем его Х), применяется для получения промышленно важного углеводорода – стирола, используемого при производстве многих видов полимеров. Выберите изомер, о котором идет речь, а также напишите уравнение реакции (с указанием условий ее проведения) получения из него стирола. Приведите 1-2 названия полимеров, для получения которых используется стирол. Хотя в промышленности упомянутый Х получают из нефти и каменного угля, попробуйте все же написать схему его получения из карбида кальция и любых, не содержащих углерод соединений. Не забудьте указать условия проведения всех реакций, для органических веществ используйте структурные формулы.
Задача 11-3.
Какие два реагента вступили в реакцию, если в результате получились только следующие вещества (приведены все продукты реакций без стехиометрических коэффициентов):
а) → MnCl2;
б) → MnCl2 + H2O;
в) → MnCl2 + Cl2↑ + H2O;
г) → MnCl2 + KCl + Cl2↑ + H2O;
д) → MnCl2 + H2↑;
е) → MnCl2 + H2O + CO2↑;
ж) → MnCl2 + SrSO4↓;
з) → MnCl2 + S2Cl2↑;
и) → MnCl2 + Mn(H2PO4)2;
к) → MnCl2 + KClO4↓.
Напишите уравнения реакций и назовите по правилам химической номенклатуры все соединения, содержащие марганец.
Задача 11-4.
Превращение виноградного сока в вино с химической точки зрения является расщеплением одной молекулы глюкозы на две молекулы этанола под действием микроорганизмов без доступа воздуха. Рассчитайте, сколько энергии получают микроорганизмы из 1 г глюкозы, если известно, что пищевая энергетическая ценность 1 г глюкозы (C6H12O6) составляет 3,9 ккал, а 1 г этанола – 7,1 ккал. Какое соединение является вторым продуктом ферментативного расщепления глюкозы без доступа воздуха?
Задача 11-5.
В популярной литературе часто ошибочно утверждается, что пищевая добавка Е***способна вызывать рак. В действительности Е***содержится во многих натуральных фруктах и ягодах и не обладает выраженной токсичностью. Получение Е***из ладана впервые описано Нострадамусом в середине 16-го века. Определите строение вещества Е***, если известно, что оно не обесцвечивает бромную воду и не реагирует с аммиачным раствором оксида серебра, а при полном сгорании его навески массой в 1,000 г образуется только углекислый газ (1,285 л при н.у.) и вода (0,4426 г). Какое действительно токсичное вещество можно получить при нагревании Е***выше 500°С?
Задача 11-6 (экспериментальная).
В трех пробирках находятся разные ациклические соединения состава С3Н6О, как химическим путем можно их различить?
А.Составьте структурные формулы ациклических соединений состава С3Н6О, назовите их по систематической номенклатуре.
Б.Составьте план действий при распознавании веществ и оформите его в виде таблицы.
 Соединения
Реактивы Соединения
Реактивы
| Формула соединения №1 | Формула соединения №2 | Формула соединения №3 |
| Название реактива и его формула | |||
| Название реактива и его формула | |||
| Название реактива и его формула |
В таблице укажите признаки использованных качественных реакций.
В.Напишите уравнения химических реакций, необходимых для идентификации этих соединений.
Г.Приведите структурные формулы циклических соединений, имеющих такую же
молекулярную формулу.
ВсОШ по химии, I школьный этап
2014-2015 учебный год
Задания
5−7 класс
Задание (5,6)7-1.
Разгадайте кроссворд и запишите отдельно ответы по горизонтали и по вертикали под
соответствующим номером.
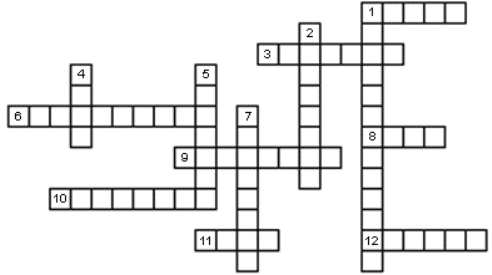
По горизонтали: 1. Наука о веществах и их превращениях. 3.1/12 часть массы атома этого элемента является эталоном для определения относительных атомных и молекулярных масс. 6. Тип химической реакции, при которой из воды образуются кислород и водород. 8. Аллотропная модификация кислорода. 9. Древнегреческий философ, основоположник учения об атомах. 10. Раствор, полученный фильтрованием. 11. Неметалл, который использовали алхимики для «получения» золота. 12. Число атомов элемента в химической формуле.
По вертикали: 1. Современный метод разделения компонентов смеси с близкими свойствами. 2. Самый распространенный в земной коре металл. 4. Единица количества вещества или насекомое, поедающее шубы. 5. Натрий в составе питьевой соды и поваренной соли. 7. Ученый, выдвинувший гипотезу, ставшую впоследствии законом: «равные объёмы различных газов при одинаковых условиях содержат одинаковое число молекул».
Задание (5,6)7-2.
Разгадайте ребусы, в которых зашифрованы названия химических элементов.



Задание (5,6)7-3.
Начав движение с верхней левой клетки и передвигаясь по горизонтали (влево или
вправо) или вертикали (вверх или вниз), пройдите все клетки так, чтобы из букв получилось правило по технике безопасности, соблюдаемое при нагревании пробирки с жидкостью. Клетка может использоваться один раз.

Задание (5,6)7-4.
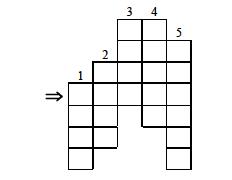
Кроссворд по распознанию знаков химических элементов. Ключевым словом является профессия, связанная с химией. 1) Cl, 2) Zn, 3) Br, 4) K, 5) Ni.
Задание (5,6)7-5(экспериментальная задача).
Разделите смесь речного песка и поваренной соли. Опишите Ваши действия.С помощью какой мерной посуды (бюретка, пипетка, мерный стакан, мерный цилиндр) можно наиболее точно отобрать 4,2 мл воды? Опишите Ваши действия.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|