
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
в) Раствор от переработки вторичного шеелита. С ним поступает ~5 % WO3 от поступившего с основным раствором, т.е. 6,2 кг. Концентрация WO3 в растворе 38 г/дм3.
б) Раствор от переработки остатка от аммиачного растворения технической вольфрамовой кислоты («кремневые отвалы»). С ним поступает ~5 % WO3 от поступившего с основным раствором, т.е.
124 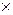 0,05 = 6,2 кг
0,05 = 6,2 кг
Концентрация WO3 в этом растворе как у основного, т.е. 155 г/дм3.
Объем этого раствора:
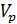 =
= 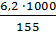 = 40
= 40 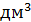
в) Раствор от переработки вторичного шеелита. С ним поступает ~5 % WO3 от поступившего с основным раствором, т.е. 6,2 кг. Концентрация WO3 в растворе 38 г/дм3.
Объем раствора:
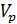 =
= 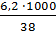 = 163,16
= 163,16 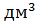
Всего поступает с возвратами:
WO3 = 2,0 + 5,0 + 5,0 = 12,0 % или 2,48 + 6,2 + 6,2 = 14,88 кг
Ввиду того, что точное количество примесей в оборотах рассчитать невозможно, примем, что относительное количество их будет тем же, что и в основном растворе.
Плотности растворов находятся интерполяцией по следующим данным для производственных растворов:
Концентрация Плотность
WO3, г/дм3 раствора, кг/дм3
246 1,27
230 1,26
214 1,22
172 1,19
104 1,12
15 1,014
4 1,00
Например, плотность раствора от переработки кремнемышьяковых отвалов составит (при концентрации в нем WO3 77,5 г/дм3):.
p = 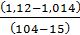 ·
· 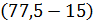 + 1,014 = 1,088 кг/
+ 1,014 = 1,088 кг/ 
Рассчитанный на основной раствор расход реагентов будем увеличивать на количество возвратов, т.е. на 12,0 %.
Плотность основного раствора и раствора «кремневых отвалов» одинакова:
ᵖ = 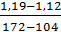 · (155 – 104) + 1,12 =
· (155 – 104) + 1,12 = 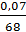 · 51 +1,12 = 1,172 кг/
· 51 +1,12 = 1,172 кг/ 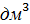
Плотность раствора вторичного шеелита равна:
ᵖ = 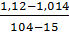 · (38 – 15) + 1,014 =
· (38 – 15) + 1,014 = 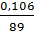 · 23 +1,014 = 1,041 кг/
· 23 +1,014 = 1,041 кг/ 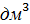 .
.
Таблица 1. Концентрации примесей и их массы в 800 дм3 раствора
| № пп | Компонент спека | Содержание в спеке, % | Концентрация соединения в растворе, г/дм3 | Концентрация и масса примеси в 800 дм3 раствора | |
| г/дм3 | кг | ||||
| Na2WO4 Na2MoO4 Na3PO4 Na3AsO4 Na2SO4 Na2CO3 Na2O Na2SiO3 NaCl | 25,21 0,03 0,10 0,06 1,15 3,00 0,11 0,54 0,11 | 196,436 0,234 0,779 0,468 8,961 23,376 0,857 4,208 0,857 | WO3=155 Mo=0,109 P= 0,147 As=0,169 8,961 23,376 NaOH=1,106 SiO2=2,071 0,857 | 0,087 0,118 0,135 7,169 18,701 0,885 1,657 0,686 | |
Примечание к таблице. Пересчет осуществляется следующим образом. Через концентрацию WO3 в растворе рассчитаем концентрацию Na2WO4:
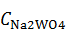 =
= 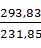 ·
· 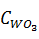 =
= 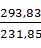 · 155 = 196,436 г/
· 155 = 196,436 г/ 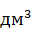
Дальнейший пересчет ведем через концентрацию вольфрамата натрия и процентное содержание в спеке вольфрамата натрия и соединения примеси. Например, концентрация молибдата натрия в растворе:
 =
= 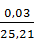 · 196,436 = 0,234 г/
· 196,436 = 0,234 г/ 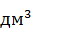
Аналогично находим концентрации других компонентов в растворе.
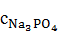 =
= 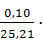 196,436 = 0,779 г/
196,436 = 0,779 г/ 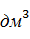
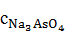 =
=  196,436 = 0,468 г/
196,436 = 0,468 г/ 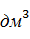
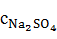 =
= 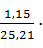 196,436 = 8,961 г/
196,436 = 8,961 г/ 
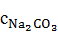 =
= 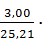 196,436 = 23,376 г/
196,436 = 23,376 г/ 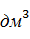
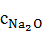 =
= 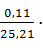 196,436 = 0,857 г/
196,436 = 0,857 г/ 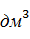
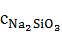 =
= 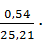 196,436 = 4,208 г/
196,436 = 4,208 г/ 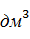
 =
= 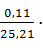 196,436 = 0,857 г/
196,436 = 0,857 г/ 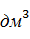
Следует иметь в виду, что при выщелачивании спека фосфат и арсенат натрия переходят в кислые соли: Na2HPO4 и Na2HAsO4.
1.2.1 Очистка раствора от кремнекислоты
Для очистки от кремнекислоты нагретый до кипения раствор нейтрализуют соляной кислотой до остаточной концентрации щелочи 2 г/дм3. Остаток нейтрализуют хлористым аммонием, взятым в двухкратном количестве.
Согласно таблице 1 содержание щелочи NaOH составляет 1,106, что меньше 2 г/дм3, следовательно нейтрализация NaOH с кислотой не проводится, поэтому HCL расходуется на нейтрализацию соды.
На нейтрализацию соды (18,7 кг из таблицы 1) потребуется соляной кислоты по реакции:
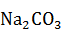 + 2HCL = 2NaCl +
+ 2HCL = 2NaCl + 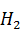 O +
O + 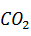
HCL = 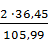 · 18,7 = 12,86 кг.
· 18,7 = 12,86 кг.
Всего необходимо HCl:
HCl = 12,86 кг.
Технической соляной кислоты с содержанием HCl 31,5 % (плотность 1,157 кг/дм3) необходимо:
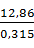 = 40,83 кг или
= 40,83 кг или  = 35,29
= 35,29  .
.
С учетом оборотов необходимо кислоты:
40,83 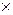 1,12 = 45,73 кг или 35,29
1,12 = 45,73 кг или 35,29 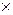 1,12 = 39,52 дм3.
1,12 = 39,52 дм3.
Требуется хлористого аммония по реакции:
NaOH + 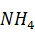 CL = NaCl +
CL = NaCl + 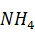 OH
OH
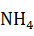 CL =
CL = 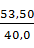 ·
· 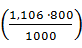 = 1,18 кг.
= 1,18 кг.
Практически берется удвоенное количество, т.е. 1,18  2 = 2,36 кг, а с учетом оборотов:
2 = 2,36 кг, а с учетом оборотов:
NH4Cl = 2,36 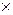 1,12 =2,64 кг или 2,64/1,53 = 1,73 дм3,
1,12 =2,64 кг или 2,64/1,53 = 1,73 дм3,
где 1,53 – плотность твердого хлористого аммония, кг/дм3. Примем, что хлористый аммоний подается в твердом виде.
Количество образующегося осадка кремнекислоты с учетом оборотов:
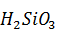 =
=  1,657 · 1,12 = 2,41 кг или
1,657 · 1,12 = 2,41 кг или 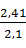 = 1,15
= 1,15 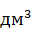 .
.
где 2,1 – плотность 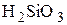 , кг/дм3.
, кг/дм3.
Отстоявшийся раствор после охлаждения сливают в реактор для очистки от мышьяка и фосфора.
1.2.2. Очистка раствора от мышьяка и фосфора
Очистку проводят добавлением расчетного количества раствора магнезиальной смеси и аммиачной воды.
Очистка протекает по реакциям:
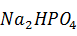 +
+ 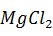 +
+ 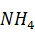 OH +
OH + 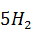 O =
O = 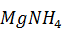 PO4 · 6
PO4 · 6 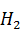 O + 2NaCL,
O + 2NaCL,
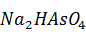 +
+ 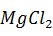 +
+ 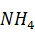 OH +
OH + 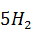 O =
O = 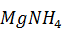 AsO4 · 6
AsO4 · 6 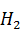 O + 2NaCL
O + 2NaCL
Расход хлорида магния:
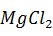 = 95,21 ·
= 95,21 · 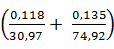 = 0,53 кг.
= 0,53 кг.
С учетом 50%-ного избытка и оборотов:
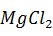 = 0,534 · 1,5 · 1,12 = 0,90 кг.
= 0,534 · 1,5 · 1,12 = 0,90 кг.
Раствора магнезиальной смеси (19 % MgCl2, 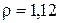 кг/дм3) необходимо:
кг/дм3) необходимо:
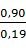 = 4,74 кг или
= 4,74 кг или 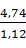 = 4,23
= 4,23 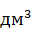 .
.
Образуется с учетом оборотов:
MgN 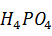 ·6
·6 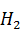 O =
O = 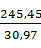 · 0,118 · 1,12 = 1,05 кг или
· 0,118 · 1,12 = 1,05 кг или  = 0,48
= 0,48 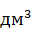
MgN 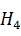 As
As 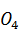 · 6
· 6 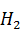 O =
O = 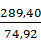 · 0,135 · 1,12 = 0,58 кг или
· 0,135 · 1,12 = 0,58 кг или 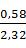 = 0,25
= 0,25 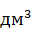
где 2,2 и 2,32 – плотности соответственно аммонийно-магниевых фосфата и арсената.
Требуется аммиака по двум реакциям:
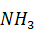 = 17,04 ·
= 17,04 · 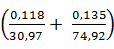 = 0,10 кг.
= 0,10 кг.
С учетом оборотов необходимо аммиака:
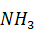 = 0,10 · 1,12 = 0,11 кг.
= 0,10 · 1,12 = 0,11 кг.
Раствора аммиака (25 % NH3, 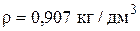 ) необходимо:
) необходимо:
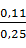 = 0,44 кг или
= 0,44 кг или 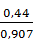 = 0,49
= 0,49 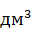 .
.
Отстоявшийся раствор сливают на нутч-фильтр, после чего перекачивают на следующую операцию. При очистке до 2 % WO3 от поступившего с основным раствором переходит в осадок в виде кислоты:
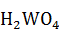 =
= 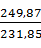 · 2,48 = 2,67 кг или
· 2,48 = 2,67 кг или 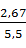 = 0,49
= 0,49 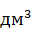 ,
,
где 5,5 – плотность вольфрамовой кислоты, кг/дм3.
H2WO4 2,67 кг или 0,49 дм3
H2SiO3 2,41 кг 1,15 дм3
MgNH4PO4∙6H2O 1,05 кг 0,48 дм3
MgNH4AsO4∙6H2O 0,58 кг 0,25 дм3
Итого 6,71 кг 2,37 дм3
На отмывку осадка расходуется пятикратное количество воды:
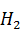 O = 6,71
O = 6,71  5 = 33,55 кг.
5 = 33,55 кг.
При влажности 40 % осадок после промывки удерживает воды (влаги):
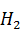 O =
O = 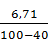 · 40 = 4,47 кг.
· 40 = 4,47 кг.
Безвозвратные потери на операции 0,1 % WO3, т.е.:
124 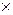 0,1/100 = 0,124 кг.
0,1/100 = 0,124 кг.
Составляем материальный баланс операции (таблица 2). Ввиду малости осадка в пульпе отнесем безвозвратные потери на счет очищенного раствора.
Масса и объем потерь:
арсената, кг / дм3.
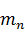 =
= 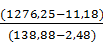 · 0,124 = 1,15 кг,
· 0,124 = 1,15 кг,
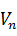 =
= 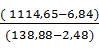 · 0,124 = 1,01
· 0,124 = 1,01 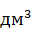 .
.
1.2.3. Очистка раствора от молибдена
Содержание молибдена в растворе от вольфрамового ангидрида составляет:
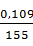 · 100 = 0,07 %,
· 100 = 0,07 %,
что меньше 0,1 %. Следовательно, необходимость в очистке от молибдена отсутствует.
| Таблица 2. Материальный баланс очистки раствора от кремнекислоты, фосфора и мышьяка | ||||||||||
| № | Поступает | Масса, кг | Объём, дм^3 | Масса WO3, кг | № | Выходит | Масса, кг | Объём, дм^3 | Масса WO3, кг | |
| Очистка | ||||||||||
| Основной раствор | 937,60 | Пульпа | 1242,7 | 1081,1 | 138,88 | |||||
| Раствор кремнемышьяковых | 34,82 | 2,48 | ||||||||
| Раствор «кремневых» отвалов (ρ= 1,172 кг/дм^3) | 46,88 | 6,2 | ||||||||
| Раствор вторичного шеелита (ρ= 1,041кг/дм^3) | 169,85 | 163,16 | 6,2 | |||||||
| Соляная кислота | 45,73 | 39,52 | - | |||||||
| Аммоний хлористый | 2,64 | 1,73 | - | |||||||
| Магнезиальная смесь | 4,74 | 4,24 | - | |||||||
| Аммиак (25%-ный) | 0,44 | 0,49 | - | |||||||
| Итого | 1242,7 | 1081,1 | 138,88 | Итого | 1242,7 | 1081,1 | 138,88 | |||
| Фильтрация и промывка | ||||||||||
| Пульпа | 1242,7 | 1081,1 | 138,88 | Очищенный раствор | 1263,92 | 1106,8 | 136,28 | |||
| Вода на промывку | 33,55 | 33,55 | - | Кремнемышьяковые отвалы, в том числе: | 11,18 | 6,84 | 2,48 | |||
| твёрдое | 6,71 | 2,37 | 2,48 | |||||||
| вода(влага) | 4,47 | 4,47 | - | |||||||
| Потери механические | 1,15 | 1,01 | 0,124 | |||||||
| Итого | 1276,25 | 1114,65 | 138,88 | Итого | 1276,25 | 1114,65 | 138,88 | |||
Заключение
Согласно заданию на курсовую работу требывалось выполнить расчет очистки раствора вольфрамата натрия от примесей.
По заданному составу спека заданным объёмом и концентрацией основного раствора рассчитали концентрацию примесей и их массы в 800 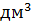 объёме раствора.
объёме раствора.
На очистку кроме основного поступают оборотные растворы, рассчитали их массы, объёмы и плотности:
Раствор от переработки кремнемышьяковых отвалов составил 2,48 кг и 32 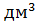 , а плотность 1,088 кг /
, а плотность 1,088 кг / 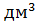 .
.
Раствор от переработки остатка от аммиачного растворения технической вольфрамовой кислоты («кремневые отвалы») составил 6,2 кг и 40 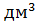 , а плотность 1,172 кг /
, а плотность 1,172 кг / 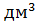 .
.
Раствор от переработки вторичного шеелита. С ним поступает ~5 % WO3 от поступившего с основным раствором, т.е. 77,5 кг, объём которого равняется 163,16 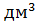 , а плотность 1,041 кг /
, а плотность 1,041 кг / 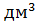 .
.
Найдём расход 31,5 % HCL, с учетом оборотов необходимо кислоты:
45,73 кг или 39,52 дм3
Рассчитали сколько требуется хлористого аммония и его количество составило 1,18 кг. Практически берется удвоенное количество, т.е. 2,36 кг, а с учетом оборотов: 2,64 кг или 1,73 дм3.
Количество образующегося осадка кремнекислоты с учетом оборотов составило: 2,41 кг или 1,15 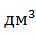 .
.
Требуется хлорида магния: 0,53 кг, а с учётом 50-%ного избытка и оборотов 0,90 кг, раствора магнезиальной смеси (19 % MgCl2) потребывалось: 4,74 кг или 4,23 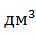
Образуется с учетом оборотов:
MgN 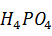 ·6
·6 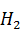 O = 1,05 кг или = 0,48
O = 1,05 кг или = 0,48 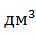
MgN 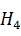 As
As 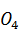 · 6
· 6 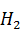 O = 0,58 кг или = 0,25
O = 0,58 кг или = 0,25 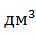
Количество аммиака, которое требуется равняется 0,10 кг
С учетом оборотов необходимо аммиака 0,11 кг, раствора аммиака (25 % ) необходимо: 0,44 кг или 0,49 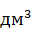
При очистке до 2 % WO3 переходит в осадок в виде кислоты равной 2,67 кг или 0,49 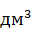
Нашли пятикратное количество воды на отмывку, которое равно 33,55 кг, а при влажности 40 % осадок после промывки удерживает воды 4,47 кг
Рассчитали безвозвратные потери на операции 0,1 % WO3, т.е.:
124  0,1/100 = 0,124 кг.
0,1/100 = 0,124 кг.
Масса потерь составила 1,15 кг или 1,01 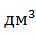 .
.
Составили таблицу материального баланса, в которой указывается, что масса очищенного раствора составила 1263,92 кг, объём 1106,8 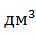 , а масса
, а масса 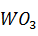 = 136,28 кг.
= 136,28 кг.
Список литературы
1. Зеликман А.Н., Коршунов Б.Г. Металлургия редких металлов. – М.: Металлургия, 1991. – 432 с.
2. Зеликман А.Н., Меерсон Г.А. Металлургия редких металлов. – М.: Металлургия, 1973. – 608 с.
3. Еремин Н.И., НаумчикА.Н., Казаков В.Г. Процессы и аппараты глиноземного производства. М.: Металлургия, 1980. 360 с.
4. Романов А.С. Расчеты по металлургии редких металлов. Методическое пособие для курсового и дипломного проектирования. Орджоникидзе, 1970. 122 с.
5. Технологические расчеты по металлургии редких металлов[Электронный ресурс]: Учебно-методическое пособие для практических занятий по дисциплине «Металлургия вольфрама и молибдена». Для студентов, обучающихся по направлению подготовки 22.03.02 – «Металлургия», направленность «Металлургия цветных металлов». Квалификация выпускника бакалавр. Форма обучения очная и заочная / Сост.: В.М. Алкацева; Северо-Кавказский горно-металлургический институт (государственный технологический университет). – Электрон. текст. дан. (843 Кб). – Владикавказ: Северо-Кавказский горно-металлургический институт (государственный технологический университет), 2019. Режим доступа: http://www.skgmi-gtu.ru/ru-ru/lib/resources/e-catalogues/ctl/DetailPublicationView/mid/3869?catalogID=4&publicationID=5d888744bc1f559ad4642ab5
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|